Abstract: Deferrizzazione delle acque naturali
1.2. Metodi di deferrizzazione dell'acqua
Per rimuovere il ferro dalle acque superficiali vengono utilizzati solo metodi reagenti seguiti da filtrazione. Deferrizzazione acque sotterranee effettuato mediante filtrazione in combinazione con uno dei metodi di pretrattamento dell'acqua:
- aerazione semplificata,
- aerazione mediante dispositivi speciali,
- coagulazione e chiarificazione,
- introduzione di reagenti ossidanti, quali cloro, ipoclorito di sodio o di calcio, ozono, permanganato di potassio;
Con motivata giustificazione vengono utilizzati anche altri metodi, ad esempio la cationizzazione, la dialisi, la flottazione, l'elettrocoagulazione, ecc.
Per rimuovere dall'acqua il ferro contenuto sotto forma di idrossido di ferro colloidale Fe(OH) 3 o sotto forma di composti organici colloidali, come gli humati di ferro, si utilizza la coagulazione con solfato di alluminio o solfato ferroso con aggiunta di cloro o ipoclorito di sodio .
Come riempitivi dei filtri vengono utilizzati principalmente sabbia, antracite, carbone solfonato, argilla espansa, pirolusite, nonché materiali filtranti trattati con un catalizzatore che accelera l'ossidazione del ferro bivalente in ferro ferrico. IN Ultimamente Stanno diventando sempre più comuni riempitivi con proprietà catalitiche: Manganese Greensand (MGS), Birm, MTM e MZhF.
Se nell'acqua è presente ferro colloidale bivalente, è necessario un test di deferrizzazione di prova. Qualora non fosse possibile effettuarla in prima fase di progettazione, scegliere una delle modalità sopra indicate in base alla deferrizzazione di prova effettuata in laboratorio o all'esperienza con impianti simili.
Aerazione semplificata
Durante il processo di aerazione, l'ossigeno atmosferico ossida il ferro bivalente, mentre l'anidride carbonica viene rimossa dall'acqua, accelerando il processo di ossidazione e successiva idrolisi con formazione di idrossido di ferro.
Questo metodo può essere utilizzato con i seguenti indicatori di qualità dell'acqua:
- contenuto di ferro totale fino a 10 mg/l, con contenuto di ferro bivalente non inferiore al 70%;
- Valore del pH non inferiore a 6,8;
- alcalinità superiore a (1+ /28) mg-eq/l, dove è la concentrazione di ferro ferroso in mg/l;
- contenuto di idrogeno solforato non superiore a 2 mg/l;
- ossidazione del permanganato non superiore a (0,15 + 5 mg/l O 2).
Se una di queste condizioni non è soddisfatta è necessaria una preliminare aerazione dell'acqua negli aeratori con l'aggiunta dei reagenti necessari (cloro, ipoclorito di sodio, permanganato di potassio, ecc.)
FeSO4 + Ca(OH)2 = Fe(OH)2 + CaSO4 (3)
Dopo la calcinazione è necessaria la decantazione e la filtrazione dell'acqua.
L'aerazione semplificata può essere ottenuta versando acqua in una tasca o canale centrale filtri aperti da un'altezza sopra il livello dell'acqua di 0,5-0,6 m.
Quando si utilizzano filtri a pressione, l'aria viene introdotta direttamente nella tubazione di alimentazione con un consumo di 2 litri per 1 g di ferro Fe 2+. Se l'acqua di fonte contiene più di 40 mg/l di anidride carbonica libera e più di 0,5 mg/l di idrogeno solforato, l'aria non viene introdotta nella tubazione. In questo caso è necessario installare un serbatoio intermedio con flusso d'acqua libero e una pompa booster davanti al filtro a pressione.
SNiP determina la velocità di filtrazione di progetto durante la deferrizzazione dell'acqua mediante aerazione semplificata utilizzando la tabella seguente.
Tabella 1
Utilizzando le caratteristiche di uno specifico riempitivo del filtro e guidati dai parametri della tabella. 1 è possibile calcolare la stazione di filtraggio. SNiP richiede che la durata del funzionamento del filtro tra i lavaggi sia pari a modalità normale almeno 8-12 ore e almeno 6 ore in modalità forzata o con automazione completa del lavaggio del filtro.
La superficie totale di filtrazione può essere determinata dalla formula:
F = Q / (T st v n - n pr q pr - n pr t pr v n), (1)
dove Q è la produttività utile della stazione di filtrazione per 1 giorno, m 3 ; T st - durata di funzionamento della stazione durante il giorno, h; v n - velocità di filtrazione stimata in modalità normale, m/h, ricavata dalla tabella. 1, tenendo conto della relazione (3); n pr - il numero di lavaggi di un filtro al giorno in condizioni operative normali; q pr - consumo specifico di acqua per un lavaggio di un filtro, m 3 / m 2 (determinato dai dati del passaporto del filtro e dalle caratteristiche operative del riempitivo); t pr - tempo di inattività del filtro dovuto al lavaggio, h (determinato dai dati del passaporto del filtro e dalle caratteristiche prestazionali del riempitivo).
Il numero di filtri in una stazione di filtraggio con una capacità superiore a 1600 m 3 /giorno deve essere almeno quattro. Con una produttività superiore a 8-10 mila m 3 /giorno, il numero di filtri N deve essere determinato arrotondando al numero intero più vicino (pari o dispari a seconda della disposizione dei filtri) utilizzando la formula:
N = (F) 0,5 / 2 (2)
In questo caso è necessario mantenere il seguente rapporto:
V f = V n N / (N - N 1) (3)
dove N 1 è il numero di filtri in riparazione; V f - velocità di filtrazione in modalità forzata.
Aerazione su dispositivi speciali
L'aerazione mediante appositi dispositivi viene utilizzata quando è necessario rimuovere il ferro dall'acqua quando la sua concentrazione nell'acqua è superiore a 10 mg/le aumentare il valore del pH superiore a 6,8.
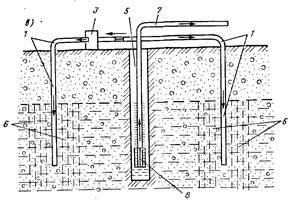
Per effettuare l'aerazione si utilizzano torri di raffreddamento ventilate (degasatori) o torri di raffreddamento a contatto con ventilazione naturale. Nella fig. La Figura 1 mostra uno schema di un impianto per la deferrizzazione dell'acqua mediante aerazione. L'acqua di fonte viene fornita attraverso il tubo da 1 a parte in alto torre di raffreddamento con ventola riempita con un ugello in ceramica 4 (anelli Raschig da 25x25x4 mm) o un ugello a corda di legno formato da barre. L'aria viene diretta verso il flusso d'acqua tramite un ventilatore 5. Durante il processo di aerazione, viene rilasciata anidride carbonica (anidride carbonica) e l'acqua si arricchisce di ossigeno. Dalla torre di raffreddamento l'acqua scorre nel serbatoio di contatto 7, da dove viene pompata nel filtro a pressione. Nel volume del riempitivo del filtro si completa la formazione di scaglie di idrossido ferrico e la loro ritenzione.
Riso. 1. Schema dell'impianto per la deferrizzazione dell'acqua mediante aerazione.
1 - tubo per fornire acqua di sorgente alla torre di raffreddamento del ventilatore; 2 - tubi di drenaggio; 3 - tubi dell'aria; 4 - ugello; 5 - ventilatore; 6 - tubo per lo scarico dell'acqua trattata; 7 - contenitore di contatto con otturatore idraulico; 8 - tubo per l'uscita dei gas dalla torre di raffreddamento.
L'area della sezione trasversale del degasatore viene calcolata in base alla densità di irrigazione (P op):
- ugello in ceramica - 60 m 3 / h per 1 m 2 di area del degasatore,
- ugello per corde di legno - 40 m 3 / h per 1 m 2 di area.
Il ventilatore del degasatore deve fornire almeno 15 m 3 di aria per metro cubo. metro di acqua trattata. La pressione sviluppata dal ventilatore deve essere determinata tenendo conto della resistenza dell'ugello. Per ogni metro di altezza dello strato di ugelli in ceramica si perdono 30 mm di acqua. Art., e per una cordata di legno - 10 mm di acqua. Arte.
Il tempo di permanenza dell'acqua nel contenitore a contatto t cont (dopo il degasatore) è di 30-45 minuti.
L'altezza dello strato dell'ugello necessaria per ridurre il contenuto di anidride carbonica nell'acqua viene determinata utilizzando la tabella. 2. Il contenuto di anidride carbonica nell'acqua fornita alla torre di raffreddamento (degasatore) dipende dalla concentrazione di anidride carbonica libera disciolta (in equilibrio) [CO 2 ] secca, mg/l e dalla durezza carbonatica dell'acqua di fonte distrutta durante l'irrigazione trattamento, mEq/l:
[CO 2 ] = ([CO 2 ] sv + 44 J k) (4)
Tavolo 2
L'unità di ossidazione e aerazione fa parte dell'impianto Deferrit, sviluppato dall'Istituto di ricerca per l'approvvigionamento idrico municipale e la purificazione dell'acqua e prodotto dall'impresa Vodkommuntekh. La produttività dell'impianto per l'acqua depurata varia da 50 a 20.000 m 3 /giorno.
ESEMPIO 1. Calcolare l'impianto di deferrizzazione con la seguente produttività:
- giornaliero, Q giorno - 12000 m 3,
- ogni ora, Q ora - 500 m 3.
La concentrazione di anidride carbonica libera è di 35 mg/l, la durezza carbonatica è di 4,5 mg-eq/l.
Per l'aerazione, utilizzare un degasatore con ventola. L'attacco del degasatore è costituito da anelli Raschig.
1. L'area del degasatore richiesta F degasatore, m 2, è determinata dalla formula:
F denaro = Q ora / P or
La densità di irrigazione del degasatore riempito con anelli Raschig è di 60 m 3 /h.
Quindi: F moneta = 500/60 = 8,33 m 2.
2. Il diametro del degasatore è determinato dalla formula:
D = (4 F gradi / 3,14) 0,5 = (4 * 8,33 / 3,14) 0,5 = 3,26 m.
3. Utilizzando l'espressione (4), determiniamo il contenuto di anidride carbonica nell'acqua di fonte: [CO 2 ] = (35 + 44*4,5) = 233 mg/l.
L'altezza dello strato di riempimento degli anelli Raschig H p è considerata, secondo la tabella 2, pari a 5,5 m.
4. Le prestazioni della ventola del degasatore sono:
Q ventilatore = 15 * Q ora = 15*500 = 7500 m 3 /h.
5. La pressione che deve sviluppare il ventilatore è pari a:
N bocca = 30 * N p = 30 * 5,5 = 165 m.
6. Volume della capacità dei contatti:
V cont = Q ora t cont /60 = 500*40/60 = 333,33 m 3.
Se prendiamo l'altezza dello strato d'acqua in un serbatoio di contatto sotto forma di un serbatoio cilindrico pari a 8 m, il suo diametro sarà di 7,3 m.
Coagulazione e chiarificazione, calcinaio
Di norma è necessario rimuovere dalle acque superficiali le sostanze sospese e le sostanze colloidali disperse, compresi i composti del ferro. La liberazione dell'acqua dalle sostanze sospese e dalle sostanze colloidali può essere ottenuta solo mediante l'introduzione di appositi reagenti coagulanti. Questo metodo di trattamento dell'acqua è chiamato coagulazione. Il coagulante forma scaglie in acqua, che assorbono i colloidi sulla loro superficie e vengono rilasciati come sedimento.
La modalità operativa e le apparecchiature per la chiarificazione e la coagulazione dell'acqua di fonte vengono selezionate in base alla natura e al livello dei contaminanti. Inoltre, se è necessario aumentare contemporaneamente l'alcalinità dell'acqua e ridurne il contenuto di sale, i processi in questione vengono combinati con la calcinazione.
Il processo di coagulazione è piuttosto complesso e non esistono stretti rapporti stechiometrici tra la dose di coagulante e la quantità di sostanze colloidali disciolte nell'acqua di sorgente. Pertanto, la dose viene determinata mediante il metodo di coagulazione del test.
Come coagulanti vengono utilizzati:
- solfato di alluminio (allumina) Al 2 (SO4) 3 * 18 H 2 O al pH dell'acqua di fonte 6,5-7,5;
- solfato di ferro (solfato di ferro) FeSO 4 * 7 H 2 O a pH dell'acqua 4-10;
- cloruro ferrico FeCl 3 * 6 H 2 O per acqua con pH 4-10.
Per intensificare il processo di coagulazione, nell'acqua vengono inoltre introdotti flocculanti (il più comune è il poliacrilammide). I flocculanti promuovono l'ingrossamento dei sedimenti e accelerano il processo di aggregazione delle particelle colloidali e sospese depositate.
Se il contenuto di durezza carbonatica nell'acqua è sufficiente (superiore a 1 mEq/l), i coagulanti formano prima bicarbonati instabili (reazione 4), che si decompongono per formare scaglie di idrossido (reazione 5):
Al 2 (SO 4) 3 + 3 Ca(HCO 3) 2 = 2 Al(HCO 3) 3 + 3 CaSO 4 (4)
FeSO4 + Ca(HCO3)2 = Fe(HCO3)2 + CaSO4
2 Al(HCO 3) 3 = 2 Al (OH) 3 ↓ + 6 CO 2 (5)
4 Fe(HCO 3) 2 + O 2 + 2 H 2 O = 4 Fe(OH) 3 ↓ + 8 CO 2
Dalla reazione 5 risulta evidente che per la formazione delle scaglie di idrossido di ferro è necessaria la presenza di ossigeno disciolto nell'acqua.
Se la durezza carbonatica dell'acqua di fonte è bassa, viene alcalinizzata con una soluzione di idrossido di sodio o “latte di calce” (soluzione di Ca(OH) 2):
4 FeSO 4 + 4 Ca(OH) 2 + 2 H 2 O + O 2 = 4 Fe(OH) 3 ↓ + 4 CaSO 4 (6)
Schiariture e decolorazioni acque agitate con durezza aumentata è preferibile utilizzare coagulanti a valori di pH elevati e acque dolci colorate a valori di pH bassi.
Quando si esegue il processo di coagulazione, la temperatura dell'acqua viene mantenuta entro 20-25 oC e quando si esegue la coagulazione con calcinaio, l'acqua viene riscaldata a 30-40 oC.
La dose di coagulante a base di solfato di alluminio viene solitamente assunta nell'intervallo 0,5-1,2 mEq/L. Per acque con contenuto moderato (fino a 100 mg/l) di sostanze sospese e bassa ossidabilità, la dose viene ridotta, mentre per acque con contenuto di ferro e elevata ossidabilità (15 mg/l O 2 e oltre), viene aumentata a 1,5 mg. -eq/l. Per le acque colorate la dose può essere determinata approssimativamente dalla formula:
D k = 4 (C) 0,5, (5)
dove D k è la dose di coagulante, mg/l; C - colore dell'acqua, gradi.
Il dosaggio del flocculante di poliacrilammide sotto forma di soluzione allo 0,1% è di 0,1-1,0 mg per ogni litro di acqua trattata (in termini di prodotto al 100%). Il flocculante viene aggiunto 1-3 minuti dopo il dosaggio del coagulante per completare la formazione di microfiocchi e l'adsorbimento dei contaminanti.
Se è necessario alcalinizzare l'acqua, la dose di alcali può essere determinata dall'espressione:
D sh = E sh (D k / E k - Sh + 1) * 100 / C, (6)
dove D sh è la dose di alcali, mg/l;
Esh è la massa equivalente della parte attiva del reagente alcalinizzante, pari a 28 per la calce (in termini di CaO) e 53 per la soda (in termini di Na 2 CO 3), mg/mg-equiv;
E k è l'equivalente di un coagulante anidro, pari a 57,02 mg/mg-eq per Al 2 (SO 4) 3 ; 75.16 - FeSO4; 54.07 - FeCl3;
Ø - alcalinità totale dell'acqua di sorgente + 1 (alcalinità di riserva), mEq/l;
C - concentrazione sostanza attiva nel reagente alcalinizzante, %.
Se il valore di Dsh calcolato utilizzando l'espressione (6) è negativo, non è necessaria l'alcalinizzazione.
Quando il contenuto di solidi sospesi nell'acqua di sorgente è inferiore a 100 mg/l, la coagulazione viene effettuata direttamente su filtri di chiarificazione con dosaggio di coagulante nella tubazione di alimentazione. La distanza dal punto di iniezione del coagulante al filtro deve essere ≥ 50 diametri della tubazione (50 Dу).
Quando la concentrazione della sospensione è superiore a 100 mg/l, nell'acqua trattata, oltre al coagulante, viene introdotta, con un opportuno intervallo di tempo, la poliacrilammide e il processo viene condotto in un chiarificatore.
Le pompe dosatrici vengono selezionate in base a dose massima coagulante. Il consumo giornaliero del coagulante (in termini di prodotto anidro al 100%, kg) è determinato dalla formula:
P k = 24*Q ora *E k *D k /1000, (7)
dove Q ora è la produttività idrica dell'impianto, m 3 / h;
Ek è l'equivalente di un coagulante anidro, pari a 57,02 per Al 2 (SO 4) 3; 75.16 - FeSO4; 54.07 - FeCl3;
D k - dose massima richiesta di coagulante, mEq/l.
Il consumo della soluzione coagulante si trova utilizzando la seguente relazione:
V k = 100 *P k / (C k *ρ k), (8)
dove V k è il volume giornaliero della soluzione coagulante, m 3 /giorno;
C a - concentrazione di coagulante nella soluzione dosata, solitamente pari al 5-10%;
ρ k - densità della soluzione coagulante, kg/m3.
Introduzione di reagenti ossidanti
L'uso di reagenti ossidanti, principalmente cloro, a scopo di disinfezione, nonché per la rimozione del ferro, è stato utilizzato in Russia dall'inizio del XX secolo. Kulsky L.A. ha sottolineato che la clorazione nella quasi totalità dei casi libera l'acqua dal ferro in essa contenuto. Dopo aver trattato diverse acque con questo metodo, il contenuto di ferro rimane in tutti i casi inferiore a 0,1 mg/l e questo metodo è efficace quando altri metodi non funzionano. Sotto l'influenza del cloro, gli umani e altri composti organici del ferro vengono distrutti e convertiti sotto forma di sali inorganici di ferro trivalente, che sono facilmente idrolizzati. Come risultato dell'idrolisi, precipita un precipitato di idrossido di ferro o prodotti di idrolisi incompleta (sali di ferro basici) composizione diversa. Questi processi possono essere descritti condizionatamente dalla seguente equazione grossolana:
4 Fe(HCO 3) 2 + 2 Cl 2 + 4 H 2 O = 4 Fe(OH) 3 ↓ + 8 CO 2 + 4 HCl (7)
Come si può vedere dall'equazione (7), l'acqua è acidificata. Secondo la stechiometria (secondo l'equazione di reazione), per l'ossidazione di 1 mg di ferro bivalente si consumano 0,64 mg di cloro, mentre l'alcalinità diminuisce di 0,018 mEq/l.
Il cloro ossida anche il manganese bivalente, distrugge materia organica e idrogeno solforato.
La dose di cloro, a seconda del contenuto di ferro, può essere di 5-20 g per 1 metro cubo. metro d'acqua al contatto, da almeno, 30 minuti (non solo per l'ossidazione del ferro, ma anche per una disinfezione affidabile). Allo stesso tempo, i requisiti igienici consentono un contenuto di cloro libero nell'acqua potabile fino a 0,5 mg/l e di cloro legato fino a 1,2 mg/l.
SNiP determina la dose calcolata di cloro (in termini di 100%, mg/l) per la rimozione del ferro utilizzando la seguente espressione:
D x = 0,7 * , (9)
dove è la concentrazione di ferro ferroso in mg/l.
La dose di cloro attivo per la disinfezione dell'acqua viene stabilita sulla base dei dati della ricerca tecnologica. Se sono assenti, per i calcoli preliminari si dovrebbero prendere 2-3 mg/l per l'acqua filtrata superficiale, 0,7-1,0 mg/l per l'acqua proveniente da fonti sotterranee.
Il trattamento dell'acqua con cloro viene effettuato utilizzando cloratori, in cui il cloro gassoso (evaporato) viene assorbito dall'acqua. L'acqua clorata dal cloratore viene fornita al punto di consumo. Sebbene questo metodo di trattamento dell'acqua sia il più comune, presenta tuttavia una serie di svantaggi. Ciò è dovuto principalmente al complesso trasporto e stoccaggio di grandi volumi di cloro liquido e altamente tossico. Nelle stazioni di trattamento dell'acqua è necessario avere rispetto dell'ambiente fasi pericolose gestione del cloro, come lo scarico dei contenitori con cloro liquido, la sua evaporazione per convertirlo in una forma funzionante. La creazione di riserve di cloro nei magazzini rappresenta un pericolo non solo per il personale operativo dell’impianto, ma anche per la popolazione.
In alternativa alla clorazione l'anno scorso Il trattamento dell'acqua con una soluzione di ipoclorito di sodio (NaClO) viene sempre più utilizzato e questo metodo viene utilizzato sia nei grandi impianti di trattamento dell'acqua che in piccole strutture, comprese le abitazioni private.
Le soluzioni acquose di ipoclorito di sodio vengono preparate chimicamente:
Cl2 + 2 NaOH = NaClO + NaCl + H2O, (8)
o elettrico metodo chimico:
NaCl + H2O = NaClO + H2, (9).
Secondo la soluzione di ipoclorito di sodio, ottenuta con il metodo chimico, è disponibile in tre gradi. Di seguito sono riportati gli indicatori per la composizione dei prodotti.
La disinfezione dell'acqua e l'ossidazione delle impurità mediante ipoclorito di sodio prodotto elettrochimicamente furono utilizzate per la prima volta negli Stati Uniti alla fine degli anni '30. Ulteriori sviluppi l'elettrochimica, lo sviluppo di progetti di nuove apparecchiature elettrochimiche utilizzando moderni materiali per elettrodi resistenti, ha permesso di creare installazioni in grado di competere con altri metodi di disinfezione dell'acqua.
Ad esempio, possiamo segnalare gli impianti elettrochimici della serie Sanator ®, sviluppati e prodotti dall'impresa Ecoservice Technokhim. L'impianto Sanator ® prepara l'ipoclorito di sodio da sale da tavola direttamente al punto di consumo. Inoltre sono dotati di un dispositivo per il dosaggio proporzionale della soluzione di ipoclorito nella tubazione di alimentazione a monte dei filtri. Nella fig. La Figura 2 mostra uno schema dell'alimentazione dell'ipoclorito alla tubazione principale; Fig. 3 diagramma schematico del collegamento dell'installazione.

Riso. 2. Schema di collegamento del gruppo tubi.
1 - tubo di alimentazione dell'acqua di sorgente; 2 - tubo di uscita dell'acqua trattata; 3 - tubo con valvola di ritegno per l'alimentazione della soluzione di ipoclorito di sodio; 4 - contatore dell'acqua; 5 - tubo flessibile con dado per raccordo; V1-V4 - valvole a sfera.

Fig.3. Diagramma schematico Collegamenti dei sanatori.
1 - cavo di rete; 2 - microcontrollore; 3 - cavo uscita impulsi; 4 - cavo di carico; 5 - blocco di distribuzione (prese); 6 - cavo di collegamento alimentazione; 7 - Alimentazione sanatore; 8 - cavo per il collegamento della pompa dosatrice; 9 - cavo per il collegamento della cassetta degli elettrodi; 10 - Serbatoio sanatore; 11 - pompa dosatrice; 12 - contatore dell'acqua; V1-V4 - valvole a sfera.
L'ipoclorito di sodio ha una serie di proprietà tecnicamente preziose. Le sue soluzioni acquose non hanno sospensioni e quindi non necessitano di sedimentazione, ad esempio, a differenza della candeggina. L'uso dell'ipoclorito di sodio per il trattamento dell'acqua non ne aumenta la durezza, poiché non contiene sali di calcio e magnesio come candeggina o ipoclorito di calcio. L'effetto battericida di una soluzione di NaClO ottenuta per elettrolisi è superiore a quello di altri disinfettanti il cui principio attivo è il cloro attivo. Inoltre, ha un effetto ossidante ancora maggiore rispetto alle soluzioni preparate chimicamente perché è più elevato alto contenuto acido ipocloroso (HClO).
L'ossidazione del ferro ferroso avviene secondo la seguente equazione:
2 Fe(HCO 3) 2 + NaClO + H 2 O = 2 Fe(OH) 3 ↓ + 4 CO 2 + NaCl (10)
Il calcolo di un impianto per il trattamento dell'acqua con ipoclorito di sodio richiede innanzitutto la determinazione del consumo di cloro attivo per i processi di ossidazione, disinfezione e distruzione dell'idrogeno solforato.
Il consumo richiesto di cloro attivo per il trattamento dell'acqua AC (in termini di cloro al 100%, g/h) è determinato dalla seguente espressione:
AX = Q ora * (D x + * K Fe ] + * K Mn + * K CB ), (9)
dove Q ora è la portata volumetrica dell'acqua (massima), m 3 / h;
D x - dose di cloro attivo per la disinfezione dell'acqua, mg/l;
Contenuto di ferro ferroso nell'acqua di fonte, mg/l;
K Fe è il consumo di cloro attivo per l'ossidazione del ferro (0,67 mg di cloro attivo per 1 mg di ferro bivalente);
K Mn è il consumo di cloro attivo per l'ossidazione del manganese bivalente (1,3 mg di cloro attivo per 1 mg di manganese);
K CB - consumo di cloro attivo per distruggere l'idrogeno solforato (2,1 mg di cloro attivo per 1 mg di idrogeno solforato).
Come risulta dall'equazione di reazione (10), durante l'ossidazione del ferro con ipoclorito di sodio, l'acqua non si acidifica e questo è molto importante per il processo di filtrazione. Inoltre, la soluzione di ipoclorito di sodio, sia commerciale che elettrochimica, è alcalina, il che è favorevole alla filtrazione.
ESEMPIO 2. Calcolare l'impianto per il trattamento dell'acqua con una soluzione commerciale di ipoclorito di sodio grado “B” con un contenuto di cloro attivo pari a 170 g/l. Prima di introdurre l'ipoclorito, diluire la soluzione 17 volte (K p - fattore di diluizione) ad una concentrazione di C p = 10 g/l (soluzione di lavoro).
Produttività oraria dell'acqua dell'impianto, Q ora - 5,5 m 3,
consumo giornaliero di acqua, Q giorno - 88 m 3, ovvero l'impianto funziona t=16 ore al giorno.
Composizione dell'acqua di fonte:
- ferro bivalente 8 mg/l,
- manganese bivalente 0,5 mg/l,
- acido solfidrico 0,4 mg/l,
- Valore pH = 6,9.
Il trattamento dell'acqua di prova ha evidenziato la necessità di introdurre 3,5 mg/l di cloro attivo a scopo di disinfezione.
1. Il consumo richiesto di cloro attivo (in termini di 100%) è determinato dall'espressione (9):
AX = 5,5 * (3,5 + 8*0,67 + 0,5*1,3 + 0,4*2,1) = 56,9 g/h.
2. Portata di alimentazione della soluzione di lavoro di ipoclorito di sodio (necessaria per selezionare una pompa dosatrice in base alle prestazioni):
Pgn = AH / C p = 56,9 / 10 ≈ 6 l/h.
3. Consumo giornaliero della soluzione di lavoro di ipoclorito (necessario per la scelta di un serbatoio per lo stoccaggio e il dosaggio della soluzione di lavoro):
Pgn*t = 6*16 = 96 l.
4. Consumo giornaliero di soluzione commerciale di ipoclorito di sodio grado “B” (necessario per determinare il costo del reagente):
R gn = P gn * t / K r = 6 * 16 / 17 = 5,6 l.
Il metodo di ossidazione del ferro ferroso viene utilizzato anche introducendo una soluzione di permanganato di potassio KMnO 4 nell'acqua di fonte prima dei filtri. Quest'ultimo può anche essere introdotto in combinazione con ipoclorito di sodio per trattare acque complesse e risparmiare un agente ossidante piuttosto costoso: il permanganato di potassio.
Quando si tratta l'acqua con permanganato, la reazione di ossidazione del ferro seguita da idrolisi procede secondo l'equazione (notazione semplificata):
4 Fe(HCO 3) 2 + MnO 4 - + 2 H 2 O = 4 Fe(OH) 3 ↓ + MnO 2 ↓ + 8 CO 2 (11)
Secondo l'equazione (11), 0,71 mg di permanganato di potassio vengono spesi per l'ossidazione di 1 mg di Fe 2+ e l'alcalinità dell'acqua diminuisce di 0,036 mEq/l. SNiP determina la dose calcolata di permanganato di potassio (in termini di 100%, mg/l) per l'ossidazione di ferro e manganese utilizzando la seguente espressione:
D pc = + 2* , (10)
dove è la concentrazione di ferro ferroso nell'acqua di sorgente, mg/l;
Concentrazione di manganese bivalente, mg/l.
Per preparare soluzioni di lavoro di permanganato di potassio, dovresti lasciarti guidare dai dati sulla solubilità del permanganato in acqua:
- ad una temperatura di 20 0 C 6,34 g KMnO 4 per 100 g di acqua;
- a 60 0 C 22,2 g KMnO 4 per 100 g di acqua.
Quando si introducono congiuntamente permanganato di potassio e ipoclorito di sodio nell'acqua trattata, le dosi di questi reagenti (in termini di prodotto al 100%, mg/l) possono essere determinate dalle equazioni:
Dpz = 0,2* + 2*, (11)
Dgn = 0,7*.
Confrontando le equazioni (10) e (11), ne consegue che l'introduzione congiunta di reagenti consente di risparmiare fino all'80% di permanganato di potassio. L'introduzione del permanganato prima dell'aggiunta dell'ipoclorito di sodio distrugge le sostanze organiche che reagiscono con il cloro formando prodotti dal forte odore, come i fenoli. Se i reagenti vengono introdotti in una sequenza diversa, il permanganato di potassio distruggerà i prodotti di cloro formati.
Uno di metodi promettenti L'ossidazione del ferro è l'ozonizzazione. L'ozono O3 è uno degli agenti ossidanti più potenti che distrugge batteri, spore e virus. Rispetto al cloro, l'uso dell'ozono è più efficace per l'ossidazione di detersivi, erbicidi, pesticidi, fenoli e per l'ossidazione di altri materiali difficilmente ossidabili composti chimici. Contemporaneamente alla disinfezione si verificano i processi di ossidazione del ferro bivalente e del manganese, la decolorazione dell'acqua, nonché la sua deodorizzazione e il miglioramento delle proprietà organolettiche.
L'ozono è ottenuto dall'aria in dispositivi speciali: ozonizzatori. Nell'ozonizzatore durante il passaggio corrente elettrica Attraverso lo spazio di scarico con aria avviene una scarica a corona, a seguito della quale si forma ozono dall'ossigeno presente nell'aria.
In base alla stechiometria, la dose di ozono per l’ossidazione del ferro ferroso può essere determinata mediante la seguente espressione:
Dose D = 0,14 * , mg/l (12)
dove è la concentrazione di ferro ferroso nell'acqua di sorgente, mg/l.
La dose di ozono dipende dallo scopo per cui viene utilizzata l'ozonizzazione dell'acqua. Per la disinfezione dell'acqua filtrata la dose di ozono è di 1-3 mg/l, per il trattamento delle acque sotterranee - 0,75-1 mg/l. Quando si introduce ozono per ossidare il ferro, decolorare l'acqua con contemporanea disinfezione, la dose può arrivare fino a 4 mg/l. La miscela ozono-aria proveniente dall'ozonizzatore viene introdotta nell'acqua mediante eiettori o attraverso una rete di tubi porosi disposti in camere di miscelazione.
La concentrazione di ozono residuo dopo le camere di miscelazione dovrebbe essere 0,1-0,3 mg/l. La durata del contatto dell'ozono con l'acqua dipende dalla composizione dell'acqua, dalla concentrazione di ozono nella miscela ozono-aria, dalla progettazione del miscelatore, dalla temperatura e in media 5-20 minuti, spesso 5-12 minuti.
La nostra industria produce ozonizzatori a bassa frequenza che funzionano con corrente a frequenza industriale, nonché ad alta frequenza (0,4-10 kHz), che sono più compatti e ad alta intensità di metallo. L'impianto di Kurgankhimmash produce in serie ozonizzatori con una produttività di ozono da 0,25 a 10 kg/h.
Va notato che l'ozono è altamente tossico e può danneggiare il sistema respiratorio. La concentrazione massima consentita di ozono nell'aria dell'area di lavoro (MPC r.z.) è 0,1 mg/m 3 . Per confronto si segnala che per il cloro questo valore è 10 volte meno gravoso e pari a 1 mg/m3.
Sebbene il metodo dell’ozonizzazione abbia prospettive brillanti, l’attrezzatura è ancora piuttosto costosa e il processo è caratterizzato da un consumo energetico relativamente elevato.
La rimozione dell'acqua dal ferro mediante scambio ionico (cationizzazione) è consentita quando è richiesto l'addolcimento dell'acqua contemporaneamente alla rimozione del ferro. Tuttavia, in questo caso, è possibile estrarre il ferro solo in forma bivalente disciolta e la durata del materiale a scambio ionico sarà notevolmente ridotta. In questo caso l'acqua da depurare deve essere priva di ossigeno.
È noto che una persona non può restare senza acqua per più di un paio di giorni, perché tutto processi metabolici nel corpo sono accompagnati dalla sua partecipazione. Pertanto, è importante pensare a che tipo di acqua utilizziamo. Può contenere un alto contenuto di cloro, sali di magnesio e calcio, manganese e ferro. Ogni tipo di impurità viene rimossa diversi modi. Diamo un'occhiata a come l'acqua viene purificata dal ferro.
Tipi di ferro
Per prima cosa devi determinare quale ferro è contenuto nell'acqua.
Bivalente. Questo tipo di ferro è altamente solubile in acqua, quindi non può essere visto ad occhio nudo. L'acqua ha una limpidezza ingannevole. Tuttavia, se viene a contatto per qualche tempo con l'aria, il ferro si ossida e si trasforma in forma trivalente. Quindi l'acqua assume una tinta rossastra.
Trivalente. Questo è ferro ossidato, in forma liquida si presenta forma colloidale(piccole particelle rosse). Spesso l'acqua contenente ferro ferrico contiene anche ferro ferroso. Inoltre, la sedimentazione delle particelle rosse può essere accompagnata dalla formazione di batteri del ferro e successivamente dal loro aumento.
Batterico. Rappresenta i batteri vivi e morti, nonché i loro prodotti di scarto e le membrane. Nella maggior parte dei casi è accompagnato da ferro colloidale. Esternamente, si tratta di depositi molli mucosi che possono o meno essere dannosi. La presenza di batteri del ferro nella tubazione porta alla corrosione per vaiolatura del ferro.

Metodi per purificare l'acqua dal ferro
Il ferro ferroso disciolto può essere rimosso metodi tradizionali, progettato per eliminare gli ioni inorganici disciolti. Questo è lo scambio ionico, la cui essenza è la sostituzione di resine speciali con ioni sodio durante la reazione e l'osmosi inversa, il suo principio è l'uso di membrane che trattengono il ferro disciolto.
Un altro metodo per purificare l'acqua dal ferro bivalente è metodo chimico. Il suo principio è l'ossidazione catalitica, durante la quale un elemento chimico passa dallo stato disciolto a quello non disciolto. Successivamente, il ferro ferrico formatosi si deposita sul filtro. Sistemi di questo tipo vengono chiamati filtri deferrizzatori.
Acqua con contenuto aumentato le particelle fini rosse vengono purificate mediante ultrafiltrazione.
Quando si elimina il ferro di tipo batterico è necessario utilizzare cloro o agenti chelanti.
Va ricordato che i metodi per purificare l'acqua dal ferro presentano i loro svantaggi e vantaggi.
Osmosi inversa
Purificare l'acqua dal ferro utilizzando l'osmosi inversa implica spingerla attraverso una membrana molto sottile. Non lascia passare nemmeno le più piccole impurità. Un simile risultato di depurazione non può essere garantito da nessun filtro per depurare l'acqua dal ferro che funzioni con un metodo diverso. Ecco perché il sistema ad osmosi inversa sembra davvero unico.
Affinché un tale filtro funzioni bene, è necessario assicurarsi completa assenza ossigeno, altrimenti si verificherà l'ossidazione e il ferro bivalente si trasformerà in ferro disperso, che successivamente si accumulerà sulla membrana. Questo non è un problema perché i sistemi ad osmosi inversa hanno una buona tenuta.
Con questo metodo è possibile eliminare anche il ferro ferrico, se presente nell'acqua in piccole quantità. La tecnologia dell'osmosi inversa consente di eliminare il manganese, noto compagno del ferro.

Metodo ionico
Questo metodo è stato utilizzato per molto tempo, ma in precedenza per purificare l'acqua venivano utilizzate zeoliti e carbonio solfonato. Attualmente, per rimuovere il ferro, vengono utilizzati speciali... Con il loro aiuto, l'efficacia di questo metodo è diventata molto più elevata. Gli scambiatori cationici utilizzati eliminano oltre al ferro bivalente anche gli ioni calcio e magnesio. Inoltre, il metodo di purificazione ionica può rimuovere il manganese, spesso presente nell’acqua.
Tuttavia, vale la pena sapere che questo metodo non funzionerà se è attivo livello normale. Dopotutto, il sistema per purificare l'acqua dal ferro mediante scambio ionico comporta la riduzione di questo indicatore. Il metodo viene utilizzato esclusivamente in intervalli di pH limitati. Inoltre quelli presenti nell'acqua hanno un effetto negativo e possono portare alla formazione di batteri sul filtro.
Il compito più difficile qui è scegliere la giusta combinazione di resine. Quindi non rimarrà traccia di ferro, perché la purificazione dell'acqua con il metodo ionico è attualmente una delle più efficaci.

Metodo chimico di purificazione dell'acqua
Un metodo ossidativo viene spesso utilizzato per purificare il ferro in forma disciolta. Implica l’uso di agenti ossidanti come permanganato di potassio, cloro, ossigeno e ozono. Con il loro aiuto, il processo di conversione del ferro disciolto in ferro ferrico viene accelerato e l'aggiunta di coagulanti all'acqua ( sostanze chimiche) favorisce la sedimentazione delle particelle. Questo principio è più spesso utilizzato in grandi sistemi pulizia.
IN condizioni di vita Viene utilizzato il metodo catalitico. La purificazione dell'acqua dal ferro è accompagnata da una reazione di ossidazione che avviene sulla superficie del filtro, le cui proprietà accelerano significativamente il processo di ossidazione. Tali sistemi sono realizzati sulla base del biossido di manganese, che può rimuovere il ferro. Per migliorare il risultato, puoi aggiungere il permanganato di potassio all'acqua.
Caratteristiche dei filtri deferrizzatori
Se la scelta è ricaduta su un sistema di purificazione dell'acqua basato sull'ossidazione del ferro, è necessario tenere conto di una serie di parametri, ovvero:
- temperatura dell'acqua;
- contenuto di ossigeno disciolto;
- alcalinità.
Questi fattori possono influenzare la qualità del lavoro. Prima dell'uso, leggere le raccomandazioni del produttore e seguirle per un ulteriore utilizzo. Particolare attenzione dovrebbe essere prestata alla velocità del flusso d'acqua in avanti e durante il controlavaggio, nonché al contenuto di ferro consentito.
Le ragioni più comuni per la scarsa efficienza dei filtri di deferrizzazione includono l'ossidazione incompleta del ferro, la fornitura di un grande volume di acqua per la purificazione e una bassa portata d'acqua durante il controlavaggio. Il coefficiente del contenuto di ferro non deve superare i 15 mg/l. I filtri di ferro hanno un peso specifico elevato, che rappresenta il loro svantaggio significativo.
Rimozione del ferro ferrico
A ottimo contenuto I sistemi di ultrafiltrazione sono considerati i più efficaci per il ferro colloidale. Il principio di funzionamento di tali sistemi è il passaggio delle particelle attraverso una rete di membrana. Come risultato di questo processo, l'acqua viene purificata dal ferro.
Per l'ultrafiltrazione vengono utilizzate membrane speciali, la cui dimensione dei pori è 0,05 μm. Efficienza questo metodo la deferrizzazione dell'acqua è dovuta al fatto che il sistema è in grado di funzionare in diverse modalità. È particolarmente importante notare il controlavaggio delle membrane, che elimina il verificarsi di blocchi.
Per ottenere una maggiore efficienza, è meglio trasferire il ferro allo stato ossidato prima della purificazione.
Metodo biologico di deferrizzazione
Il metodo biologico mira a convertire il ferro disciolto nella forma di ossido utilizzando batteri del ferro. Non rappresentano un pericolo per l'uomo, a differenza dei loro prodotti di scarto.
I batteri del ferro sono attivi a livelli di ferro compresi tra 10 e 30 mg/l, ma possono svilupparsi anche quando il contenuto di impurità nocive è inferiore a questi valori. Affinché i microrganismi possano esistere normalmente, è necessario mantenere l'ambiente acido a un livello basso, fornendo contemporaneamente ossigeno dall'aria.
Insomma metodo biologico deferrizzazione, i prodotti di scarto dei batteri del ferro vengono rimossi per adsorbimento, quindi l'acqua viene trattata con raggi battericidi per purificare infine il liquido.
Naturalmente, questo metodo è ecologico ed efficace, ma presenta un grosso svantaggio: la bassa velocità del processo. Inoltre, affinché le prestazioni di pulizia siano al livello adeguato, è necessario disporre di grandi serbatoi di pulizia.

Depurazione dell'acqua potabile
A casa, la purificazione dell'acqua viene effettuata utilizzando i seguenti metodi:
- Difesa. Questo è il metodo più elementare: l'acqua viene lasciata per diverse ore, durante le quali impurità e sedimenti depositano sul fondo. Tuttavia, l'efficacia di questo metodo è bassa, dopo la procedura il liquido dovrà essere bollito.
- Congelamento. L'acqua deve essere versata in un contenitore e posta nel congelatore. Dopo che la parte principale si è trasformata in ghiaccio, la parte rimanente deve essere drenata: contiene impurità. Quando si scongela l'acqua, è necessario buttare via gli ultimi pezzi di ghiaccio, che contengono anche
- Shungite e silicio. I minerali devono essere posti sul fondo del contenitore, quindi riempiti d'acqua e lasciati per almeno due giorni. Dopo il tempo, l'acqua che è in superficie può essere scaricata e consumata, ma l'acqua “di fondo” deve essere versata perché conterrà sedimenti. La shungite e il silicio fungono da buoni purificatori liquidi dalle impurità nocive.
- Carbone. Questo medicinale ti permetterà di eliminare sedimenti e impurità meccaniche. Devi avvolgere il carbone in un batuffolo di cotone e far passare l'acqua attraverso il filtro fatto in casa risultante.

Perché purificare l'acqua dal ferro?
La presenza di ferro nell'acqua non filtrata ne rovina l'odore e il sapore. Inoltre, le particelle di impurità non disciolte colorano il liquido marrone. Bere costantemente acqua con molto ferro può portare a varie malattie principalmente legati ai reni e al fegato. Influirà negativamente anche sulle condizioni della pelle; reazioni allergiche e i sedimenti si accumuleranno nel sistema di drenaggio.
Oltre a causare danni alla salute umana, il ferro nell'acqua porterà a conseguenze quali la comparsa di macchie sugli impianti idraulici colore giallo, crescita eccessiva delle condotte e loro corrosione, declino significativo e guasto delle attrezzature nelle imprese.
Il valore ottimale del contenuto di ferro nell'acqua è 0,3-0,5 mg/l. A valori più alti si formerà ruggine, mentre a valori più bassi apparirà torbidità.

Costo della deferrizzazione dell'acqua
Se l'acqua del tuo rubinetto scorre con... odore sgradevole e gusto, quindi purificare l'acqua dal ferro aiuterà a far fronte a questo problema. Il prezzo dei filtri varia a seconda del tipo e del metodo di azione.
La più comune è una caraffa filtrante, il cui principio di funzionamento si basa sull'ingresso dell'acqua nel contenitore attraverso uno strato di assorbente. Il costo di una tale brocca varia da 200 a 2500 rubli.
I filtri che dovrebbero essere posizionati sotto il lavandino hanno un costo maggiore. I sistemi di osmosi inversa si trovano sul mercato a prezzi a partire da 5.000 rubli e la filtrazione elettrochimica costerà circa 25.000 rubli.
Il costo del prodotto è influenzato dalla presenza di un serbatoio di stoccaggio, dal suo volume e dal grado di purificazione.
Non dimenticare che è meglio lasciare l'installazione di un impianto di depurazione dell'acqua dal ferro a specialisti, i cui servizi dovranno essere spesi.
Assistenza online solo su appuntamento
Il grado richiesto di rimozione del ferro dall'acqua sarà determinato dagli scopi finali per i quali verrà utilizzata quest'acqua. E anche se oggi non esiste un unico metodo universale per la rimozione completa di tutti forme esistenti ferro dall'acqua, utilizzando l'uno o l'altro schema di purificazione, è possibile ottenere risultato desiderato in ogni caso specifico.
Deferrizzazione ossidativa
I metodi tradizionali di deferrizzazione dell'acqua si basano sull'ossidazione del ferro bivalente con ossigeno atmosferico (aerazione) e forti agenti ossidanti (cloro, permanganato di potassio, perossido di idrogeno, ozono) allo stato trivalente, con formazione di idrossido di ferro (III) insolubile, che viene successivamente eliminato mediante decantazione, decantazione con aggiunta di coagulanti e flocculanti (A-T 9.303) e (o) filtrazione.
Aerazione
L'ossidazione del ferro mediante aerazione può essere effettuata: a zampillo (i cosiddetti impianti a spruzzo), a doccia, utilizzando un iniettore, un eiettore o un compressore, introducendo aria in un tubo sotto pressione, facendo gorgogliare.
In molti casi, l'acqua che ha subito la deferrizzazione mediante aerazione, seguita da sedimentazione e filtrazione, è già potabile. Secondo questo schema semplificato, la deferrizzazione è efficace quando la concentrazione iniziale di ferro non supera i 10 mg/ml (con un contenuto di ferro bivalente pari ad almeno il 70% del totale), e la concentrazione di H2S non supera i 2,5 mg/l. Il potenziale di ossidoriduzione (potenziale redox) dell'acqua dopo l'aerazione non deve essere inferiore a 100 mV e l'indice di stabilità (indice di Langelier) non deve essere inferiore a 0,05.
La scelta del metodo di aerazione semplificato dipende dai parametri dell'acqua di fonte. Pertanto, se la concentrazione di idrogeno solforato è superiore a 0,5 mg/l e l'anidride carbonica libera è superiore a 40 mg/l, non è necessario introdurre aria sotto pressione nella tubazione: è sufficiente fornire un contenitore aperto con flusso d'acqua al suo interno. Un effetto simile può essere ottenuto zampillando o facendo la doccia.
Ossidazione del ferro ferroso con aggiunta di forti agenti ossidanti
L'aggiunta di forti agenti ossidanti all'acqua intensifica significativamente il processo di ossidazione del ferro bivalente. Quella più utilizzata è la clorazione, che permette di risolvere anche il problema della disinfezione dell'acqua, mentre l'ozonizzazione è la più efficace (Fig. 2). Se non altro perché, ad eccezione dell'ozono, altri agenti ossidanti risultano inefficaci rispetto al ferro organico. Tuttavia, l’ozonizzazione è anche il metodo più costoso, poiché richiede grandi quantità di elettricità. Inoltre, la rimozione del ferro avviene quasi sempre contemporaneamente alla rimozione del manganese dall'acqua, che è molto più difficile da ossidare rispetto al ferro, e a valori di pH più elevati.
Precipitazione del ferro colloidale mediante il tradizionale metodo industriale
In condizioni normali, il processo di precipitazione delle particelle colloidali di idrossido ferrico (dimensione delle particelle 1–3 μm) dopo la sedimentazione avviene lentamente. L'ingrandimento delle particelle e, quindi, l'accelerazione della sedimentazione si ottiene aggiungendo coagulanti. Lo stesso è richiesto dall'utilizzo di filtri a sabbia o antracite negli impianti di trattamento, che non sono in grado di trattenere piccole particelle. Questi filtri trattengono inoltre scarsamente il ferro organico.
La lenta precipitazione delle particelle colloidali di idrossido di ferro (III), unita alla bassa efficienza dell'uso di agenti ossidanti e dell'aerazione rispetto al ferro organico, nonché alla limitazione della concentrazione superiore di ferro nell'acqua di fonte, rendono difficile utilizzare il tradizionale schema di rimozione del ferro industriale in aree relativamente piccole sistemi autonomi lavorare con elevata produttività. In tali schemi vengono utilizzati altri impianti in cui la rimozione del ferro viene effettuata secondo i principi dell'ossidazione catalitica, seguita da filtrazione e scambio ionico.
Ossidazione catalitica con filtrazione
Questo è il metodo più utilizzato oggi per l'approvvigionamento idrico industriale di imprese individuali, non molto grandi, singoli cottage. Gli impianti per l'ossidazione catalitica e la filtrazione sono compatti e caratterizzati da una produttività piuttosto elevata (0,5–20,0 m3/h o più, a seconda dell'assorbente, delle qualità iniziali dell'acqua e delle caratteristiche geometriche del serbatoio - un cilindro in fibra di vetro o acciaio inossidabile ). La reazione di ossidazione del ferro avviene all'interno del serbatoio dell'impianto su granuli di riempimento, uno speciale mezzo filtrante con proprietà catalitiche. Innanzitutto le proprietà catalitiche e filtranti di questi materiali sono determinate dalla loro elevata porosità, che fornisce un mezzo affinché avvenga la reazione di ossidazione e ne determina la capacità di assorbimento.
Il materiale sintetico Birm è ampiamente utilizzato come materiale di riempimento catalitico, consentendo di rimuovere in modo efficace ed economico dall'acqua i composti di ferro e manganese a basse e medie concentrazioni. Le unità di riempimento Birm sono fornite con acqua pre-aerata. La proporzione di ossigeno disciolto in esso deve essere almeno pari al 15% della proporzione di ferro (o ferro e manganese). L'elevata porosità del materiale e la bassa densità apparente (0,7–0,8 g/cm3) facilitano la rimozione dei sedimenti durante il controlavaggio. L'alcalinità dell'acqua di fonte dovrebbe essere il doppio della concentrazione di cloruri e solfati. Gli svantaggi del materiale Birm sono la sua elevata tendenza all’abrasione, a causa della quale ogni anno viene perso fino al 10–15% del materiale di riempimento, e non la più ampia gamma di valori di pH operativi – 8,0–9,0. Il suo vantaggio è il basso costo.
Molto utilizzati sono anche i materiali di riempimento catalitici a base di minerali naturali, come la dolomite, la zeolite e la glauconite. Viene utilizzata anche la zeolite sintetica.
A base di dolomite contenente carbonati di calcio e magnesio, vengono prodotti materiali di riempimento catalitici come Magnofilt e Damfer, caratterizzati da elevata porosità, che contribuisce alla manifestazione di proprietà catalitiche, un'ampia gamma di temperature operative, reazione alcalina. L'alcalinizzazione del mezzo accelera la reazione di ossidazione del ferro ferroso con l'ossigeno disciolto in acqua. Durante il trattamento termico, il carbonato di magnesio contenuto nella dolomite si trasforma in ossido di MgO; a contatto con l'acqua, l'ossido si idrolizza e rilascia nella soluzione ioni idrossile, che a loro volta legano gli ioni idrogeno e contribuiscono ad accelerare la reazione di ossidazione del ferro bivalente. Questa caratteristica è tipica di tutti i materiali filtranti con proprietà catalitiche a base di dolomite. I grani di dolomite, tra le altre cose, sono chimicamente resistenti e molto durevoli, quindi praticamente non si consumano durante il funzionamento. Esistono alcune restrizioni per Magnofilt: oli e idrogeno solforato non devono essere presenti nell'acqua di fonte, il contenuto di sostanze organiche non deve superare 4–5 mg/l, la percentuale di ossigeno disciolto deve essere superiore del 15% rispetto alla percentuale di ossigeno disciolto ferro, pH = 6,8–8, 5. A valori di pH più elevati si formano forme colloidali di ferro ferrico, difficili da filtrare. La clorazione riduce l'attività di questo materiale, quindi il dosaggio del cloro dovrebbe essere minimo.
Dapher presenta ulteriori vantaggi. Le proprietà catalitiche intrinseche della dolomite sono migliorate grazie al fatto che nella fase trattamento termico Il materiale contiene ferro in forma cataliticamente attiva, nonché altri additivi catalitici: rame, argento, manganese, fosfati. La presenza di argento in questo materiale consente inoltre di sopprimere la crescita dei batteri del ferro. Rispetto al materiale Birm, il tasso di ossidazione del ferro su Damfer è 250 volte superiore. Inoltre, questo materiale può funzionare a valori di pH inferiori a 6,0, purifica l'acqua sia dal ferro bivalente che trivalente e non è avvelenato dall'idrogeno solforato e dal cloro residuo. Lo strato di idrossido di ferro (III) formatosi durante la purificazione sui granuli Damfer ne potenzia ulteriormente le proprietà catalitiche. In primo luogo, promuove ossidazione catalitica il ferro, in secondo luogo, avendo una struttura spugnosa, è un ulteriore assorbente, che assorbe particelle di sabbia, argilla, metalli pesanti e perfino gli acidi umici.
Un altro materiale ampiamente utilizzato per la filtrazione ossidativa catalitica è ottenuto dalla sabbia verde di glauconite: Glauconite Manganese Greensand. Durante la lavorazione della sabbia glauconitica, nella composizione di Greensand vengono introdotti ossidi di manganese superiori, che forniscono ulteriore capacità ossidante a questo materiale. Inoltre, oltre alle proprie proprietà catalitiche e ossidanti, Greensand lega agenti ossidanti come permanganato di potassio, cloro e ossigeno disciolto. Tutto ciò garantisce un'elevata velocità e completezza delle reazioni ossidative. Greensand ha la più alta capacità di assorbimento ed è efficace nel purificare l'acqua con alte concentrazioni di ferro e manganese (fino a 10 mg/l in totale) in un ampio intervallo di pH compreso tra 6,2 e 8,8. I sistemi riempiti con questo materiale vengono utilizzati per purificare l'acqua da pozzi di qualsiasi profondità. L'idrogeno solforato viene ossidato in solfati insolubili. Le precipitazioni vengono filtrate da uno strato di Greensand e dai relativi strati filtranti. L'assorbente non è sensibile ai microrganismi o alle impurità organiche e non richiede disinfezione. La rigenerazione del terreno viene effettuata con una soluzione di permanganato di potassio, seguita da lavaggio con acqua di fonte.
Esistono altri materiali con attività catalitica e ossidativa utilizzati come materiali di riempimento per i filtri deferrizzatori, ma utilizzando gli esempi sopra riportati è possibile farsi un'idea dei principi di base della deferrizzazione utilizzando questo metodo.
Metodo di scambio ionico per la rimozione del ferro
Per rimuovere il ferro con questo metodo, vengono utilizzati scambiatori cationici (Fig. 3). Inoltre, la zeolite e altri scambiatori ionici naturali vengono sempre più sostituiti da resine sintetiche a scambio ionico; l'efficienza dell'utilizzo dello scambio ionico aumenta in modo significativo.
Qualsiasi scambiatore cationico è in grado di rimuovere dall'acqua non solo il ferro bivalente disciolto, ma anche altri metalli bivalenti, in particolare calcio e magnesio, per i quali vengono principalmente utilizzati. Teoricamente, il metodo dello scambio ionico può rimuovere molto alte concentrazioni ferro, senza richiedere la fase di ossidazione del ferro ferroso disciolto per ottenere idrossido insolubile. Tuttavia, in pratica, le possibilità di utilizzare questo metodo sono significativamente limitate.
Innanzitutto, l'utilizzo dello scambio ionico per la rimozione del ferro limita la presenza di ferro ferrico, che “intasa” rapidamente la resina e da lì viene scarsamente lavato. Pertanto, qualsiasi presenza di ossigeno o altri agenti ossidanti nell'acqua che passa attraverso lo scambiatore ionico è estremamente indesiderabile. Ciò limita anche l'intervallo di valori di pH in cui la resina è efficace.
In molti casi, l'uso di resine a scambio ionico per la rimozione del ferro non è pratico, poiché, avendo una maggiore affinità per gli scambiatori cationici, il ferro riduce significativamente l'efficienza della rimozione degli ioni calcio e manganese da essi e della demineralizzazione generale. La presenza di sostanze organiche nell'acqua, compreso il ferro organico, porta ad una rapida crescita eccessiva resina a scambio ionico pellicola organica che funge da terreno fertile per i batteri. Ecco perché scambiatori cationici a scambio ionico Di solito vengono utilizzati per la rimozione del ferro solo nei casi in cui è richiesta un'ulteriore purificazione dell'acqua secondo questo parametro alle concentrazioni più basse e quando è possibile la rimozione simultanea degli ioni di durezza.
Rimozione del ferro mediante metodi a membrana
Le membrane di microfiltrazione sono adatte per rimuovere particelle di idrossido di ferro colloidale (III); le membrane di ultrafiltrazione e nanofiltrazione possono anche rimuovere il ferro organico colloidale e batterico, mentre il metodo dell'osmosi inversa consente di rimuovere fino al 98% del ferro bivalente disciolto in acqua. Tuttavia, i metodi a membrana sono costosi e non sono specificatamente progettati per la rimozione del ferro. Ciò avviene durante il processo di disinfezione dell'acqua (membrane di microfiltrazione), durante la sua purificazione profonda (ultrafiltrazione e nanofiltrazione) o di desalinizzazione (osmosi inversa). Inoltre, le membrane si ricoprono facilmente di una pellicola organica e intasano la superficie con particelle insolubili, inclusa la ruggine, e assorbono anche il ferro bivalente disciolto e perdono la capacità di trattenere efficacemente altre sostanze. I produttori di membrane ad osmosi inversa garantiscono la conservazione delle loro proprietà tecnologiche durante il funzionamento in caso di manutenzione ferro totale in acqua non più di 0,1-0,3 mg/l, impurità sospese - non più di 0,5-0,6 mg/l, ossidazione del permanganato - non più di 5 mg O2/l e indice colloidale non più di 2-4 unità (parametri che tengono conto conto del contenuto di ferro organico).
Tuttavia, l'uso dei metodi a membrana è giustificato laddove è semplicemente necessario alto grado purificazione dell'acqua, compresa la rimozione del ferro, ad esempio in ambito medico o Industria alimentare(Fig. 4).
Deferrizzazione biologica
Questo metodo prevede l'uso di batteri di ferro che ossidano il ferro bivalente disciolto in ferro trivalente per la purificazione dell'acqua, seguito dalla rimozione di colloidi e pellicole batteriche nei serbatoi di decantazione e nei filtri. In alcuni casi, questo è l’unico modo accettabile per ridurre i livelli di ferro nell’acqua. Innanzitutto quando le concentrazioni di ferro nell'acqua sono particolarmente elevate, superiori a 40 mg/l. La deferrizzazione biologica viene utilizzata anche se l'acqua contiene elevati livelli di idrogeno solforato e anidride carbonica. Quest'acqua è molto basso tasso di Il pH non può essere eliminato dal ferro in eccesso mediante un'aerazione semplificata. Si filtra attraverso colonie batteriche su filtri lenti con caricamento di sabbia e ghiaia. Quindi vengono sottoposti alla purificazione per assorbimento per trattenere i prodotti di scarto batterici e alla disinfezione con raggi ultravioletti.
Termini
Scambiatori di cationi:– assorbenti a scambio ionico in grado di scambiare cationi al contatto con soluzioni elettrolitiche.
Scambiatori di ioni (scambiatori di ioni, assorbenti a scambio ionico):– sostanze capaci di scambio ionico al contatto con soluzioni elettrolitiche.
Resine a scambio ionico:– polimeri a scambio ionico, ioniti organici sintetici. Polimeri solidi, insolubili, reticolati che si rigonfiano in misura limitata in soluzioni elettrolitiche e solventi organici, capaci di dissociazione elettrolitica e scambio ionico al contatto con soluzioni elettrolitiche.
Potenziale redox:– potenziale elementi chimici in una serie di tensioni elettrochimiche relative al potenziale di un normale elettrodo a idrogeno a 18 o C.
Le acque sotterranee in molte regioni del mondo sono spesso caratterizzate da un elevato contenuto di ferro. Ad esempio, in Indocina, le acque sotterranee con un contenuto di ferro superiore agli standard sono circa il 60%. Le acque contenenti ferro sono diffuse nel nord e Europa centrale, in Siberia e Lontano est, nel Nord America, nell'Africa meridionale.
Un maggiore contenuto di ferro nell'acqua le conferisce un colore brunastro, sgradevole gusto metallico, provoca la crescita eccessiva delle reti di approvvigionamento idrico e degli impianti idrici, provocando difetti nell'industria tessile, alimentare, cartaria, chimica e di altro tipo. Livelli elevati di ferro nell’acqua potabile sono dannosi per la salute umana. Con l'introduzione prolungata di ferro nel corpo, il suo eccesso si accumula nel fegato sotto forma colloidale di ossido di ferro, chiamato emosiderina, che ha un effetto dannoso sulle cellule del fegato, provocandone la distruzione. Pertanto l'acqua ad alto contenuto di ferro deve essere deferrizzata.
La varietà di forme e concentrazioni di ferro presenti in natura e acque reflue, ha reso necessario lo sviluppo di una serie di metodi, schemi tecnologici e strutture per la deferrizzazione dell'acqua. Un grande contributo alla risoluzione del problema della deferrizzazione delle acque naturali e riciclate è stato dato dagli scienziati russi I.E. Apelcin, V.A. Klyachko, G.I. Nikoladze, L.A. Kulsky, A.M. Perlina, K.A. Mamontov, G.Yu. Culo.
Nelle acque superficiali il ferro si presenta solitamente sotto forma di composti complessi organici e minerali, oppure di sospensioni colloidali o fini. La forma predominante di esistenza del ferro nelle acque sotterranee è il bicarbonato di ferro (II), che è stabile solo in presenza quantità significative anidride carbonica e mancanza di ossigeno disciolto. Insieme a questo, il ferro si trova sotto forma di solfuro, carbonato e solfato di ferro (II), composti complessi con umati e acidi fulvici.
L'idrossido di ferro può essere presente nell'acqua allo stato colloidale, che è una delle principali forme di esistenza. Ciò è notevolmente migliorato da effetto protettivo sostanze umiche come risultato del fatto che le particelle di un colloide instabile all'acqua (idrofobo) assorbono sulla loro superficie particelle di un altro colloide, che ha una connessione più forte con le molecole d'acqua, cioè ha un carattere idrofilo. Il ferro può essere trasferito da questo complesso al sedimento in due modi: naturale - con la partecipazione di batteri che distruggono la materia organica e artificialmente - con l'aiuto di forti agenti ossidanti che distruggono i colloidi protettivi. Allo stesso tempo, la precipitazione dell'idrossido di ferro dallo stato colloidale è facilitata dalla presenza di sol di acido silicico con carica opposta (coagulazione).

Riso. 1. Diagrammi di Pourbaix per ferro (a) e manganese (b).
Nella fig. 1, e viene presentato il diagramma di Pourbaix, che riflette lo stato del sistema ferro - acqua nelle coordinate potenziale redox - valore pH. Le linee rette verticali mostrano i valori di pH della formazione di idrati nell'effettivo equilibrio nel sistema. Come segue dal diagramma, a valori di pH<4,5 железо находится в воде в виде ионов Fe3+, Fe2+ и Fe(OH)2+. Повышение значения рН приводит к окислению железа(II) в железо(III), которое выпадает в осадок. В этих же условиях при Е<0,2 В и наличии в воде сульфидов может выделяться черный осадок FeS. В восстановительной среде в присутствии карбонатов и при рН>8.4 è possibile il rilascio di carbonato e a pH> 10,3 - idrossido di ferro (II).
In presenza di catalizzatori - ioni rame, manganese e fosfato disciolti nell'acqua da trattare, nonché quando entra in contatto con ossidi di manganese o con idrossido di ferro (III) precedentemente precipitato, la velocità di ossidazione del ferro (II) con l'ossigeno aumenta in modo significativo (Fig. 2.2, a) . Con un aumento del valore del pH dell'ambiente, il tempo impiegato per l'ossidazione dei composti di ferro (II) viene significativamente ridotto. Secondo la reazione avviene l'ossidazione del ferro (I) da parte dell'ossigeno atmosferico
4Fe2+ + 02 + 8HCO3- + 2H2O = 4Fe(OH)3 + 8C02


Riso. 2. Grafici dell'ossidazione del ferro (I) da parte dell'ossigeno in presenza di catalizzatori (a) e cinetica della sua ossidazione da parte dell'ossigeno, cloramina e cloro (b) a diversi pH dell'acqua. 1 - senza catalizzatore; 2, 3 - in presenza di biossido di rame e manganese (dosi di 0,02 mg/l); 4 - in presenza di esametafosfato (dose 2 mg/l);
Secondo la stechiometria, per l'ossidazione di 1 mg di ferro (II) vengono consumati 0,143 mg di ossigeno disciolti in acqua; Allo stesso tempo l'alcalinità dell'acqua diminuisce di 0,036 mg-eq/l. Il tasso di ossidazione dei composti del ferro(II) aumenta significativamente quando l'acqua viene clorata (potenziale redox normale del cloro E = 1,36 V). I composti del Ferro(II) in presenza di idrocarbonati delle acque naturali vengono completamente idrolizzati secondo la reazione:
2Fe2+ + C12 + 6HCO3- = 2Fe(OH)3 + 2Cl+ 6C02
Secondo la stechiometria, per l'ossidazione di 1 mg di ferro (II) vengono consumati 0,64 mg di cloro; Allo stesso tempo l'alcalinità dell'acqua diminuisce di 0,018 mg-eq/l. Come si può vedere dalla figura. 2.2, b, quando si sostituisce il cloro libero con dicloramina (E = 0,66 V a pH 5), il tempo necessario per l'ossidazione dei composti di ferro (II) aumenta in modo significativo.
Quando si tratta l'acqua con permanganato di potassio, la reazione di ossidazione e la successiva idrolisi procede secondo l'equazione
4Fe2+ + MnO4- + 8HCO3- + 2H20 = 4Fe(OH)3 + MnO2 + 8C02
Secondo la stechiometria, per l'ossidazione di 1 mg di ferro (II) vengono consumati 0,71 mg di permanganato di potassio; In questo caso l'alcalinità dell'acqua diminuisce di 0,036 mg-eq/l.
Per deferrizzare l'acqua, dovrebbero essere utilizzati diversi metodi a seconda delle forme, della quantità di ferro e delle proprietà tampone dell'acqua di fonte. L'intera varietà di metodi utilizzati nella tecnologia di deferrizzazione dell'acqua può essere ridotta a due tipi principali: reagenti e non reagenti. Tra i metodi di deferrizzazione dell'acqua senza reagenti attualmente utilizzati, i seguenti sono promettenti: aerazione e filtrazione con espulsione del vuoto (Fig. 2.3, a); aerazione e filtrazione semplificate; "filtrazione a secco"; filtrazione su filtri a telaio; filtrazione in condizioni sotterranee con fornitura preliminare di acqua ossidata o aria nella formazione (Fig. 2.4); aerazione e filtrazione a due stadi; ultrafiltrazione.
I reagenti includono seguenti metodi: aerazione semplificata, ossidazione, filtrazione, flottazione a pressione con calcinaio e successiva filtrazione; calcinaio, decantazione in vasca di sedimentazione a strato sottile e filtrazione, filtrazione a carico modificato; elettrocoagulazione, cationizzazione; ozonizzazione e filtrazione.

La varietà di metodi per deferrizzare l'acqua esclude la loro equivalenza in termini di affidabilità, producibilità, fattibilità economica, semplicità, ambito di applicazione, ecc. La deferrizzazione delle acque superficiali può essere effettuata solo con metodi reagenti e per la rimozione del ferro dalle acque sotterranee, i metodi senza reagenti sono quelli più ampiamente utilizzati.
I metodi di deferrizzazione senza reagenti possono essere utilizzati quando l'acqua di fonte è caratterizzata da: pH - almeno 6,7; Alcalinità - non inferiore a 1 mEq/l; ossidazione del permanganato - non più di 7 mg 02/l. In questo caso, quando il contenuto di ferro(III) non supera il 10% del totale e la concentrazione di ferro(II) sotto forma di bicarbonato o carbonato è fino a 3 mg/l, il metodo di filtrazione su filtri a telaio senza filtro ausiliario si consiglia il mezzo; fino a 5 mg/l, è preferibile utilizzare il metodo a secco; da 5 a 10 mg/l, la filtrazione dovrebbe utilizzare il metodo di aerazione semplificato con filtrazione a stadio singolo; dalle 10 alle 20 - aerazione e filtrazione a due stadi; da 10 a 30 mg/l - si consiglia l'aerazione con espulsione sotto vuoto con filtrazione tramite caricamento di una grande capacità di sporco.

Quando la concentrazione di anidride carbonica o carbonato di ferro (I) è superiore a 20 mg/l o quando il contenuto di idrogeno solforato è 1...5 mg/l, pH 6,4, il metodo di aerazione con espulsione sotto vuoto con successiva sedimentazione in strato sottile acqua o trattamento in uno strato di sedimento sospeso e filtrazione.
I metodi reagenti per deferrizzare l'acqua devono essere utilizzati a bassi valori di pH, elevata ossidabilità e instabilità dell'acqua. In questo caso, quando il contenuto di solfato o carbonato di ferro, o composti organici complessi del ferro: fino a 10 mg/l e l'ossidazione del permanganato fino a 15 mg O2/l, si consiglia di utilizzare la filtrazione attraverso un carico modificato, fino a 15 mg/le ossidazione con permanganato fino a 15 mg O2/l è preferibile un metodo che prevede aerazione semplificata, trattamento con un forte agente ossidante e filtrazione attraverso un carico granulare con grande capacità di trattenere lo sporco; superiore a N. mg/le ossidazione del permanganato superiore a 15 mg/l, si dovrebbe utilizzare la flottazione a pressione con calcinaio preliminare e successiva filtrazione o un metodo che comporti aerazione, calcinaio, sedimentazione in uno strato sottile e filtrazione; oltre 10 mg/l, ossidazione del permanganato oltre 15 mg 02/l con produttività della pianta fino a 200 m3/giorno, si può consigliare elettrocoagulazione con gorgogliamento, decantazione in strato sottile e filtrazione.

Riso. 2.3. Schemi tecnologici degli impianti di deferrizzazione dell'acqua.
a - aerazione e filtrazione con espulsione sotto vuoto; b - aerazione semplificata con filtrazione a stadio singolo; c - aerazione semplificata con filtraggio a due stadi; g - filtrazione a secco; d - calcinaio; e - filtraggio attraverso lo strato alluvionale; 1 I 8 - fornitura di acqua iniziale e rimozione di acqua priva di ferro; 2 - apparecchio per l'espulsione del vuoto; 3 - filtri di riempimento del frame; 4 - serbatoio acqua lavaggio; 5 - pompa booster; 6 e 11 - impianto per fluorizzazione e disinfezione dell'acqua; 7 - serbatoio dell'acqua; 9 - ventilatore; 10 - filtro di chiarificazione veloce; 12 - dispositivo di aerazione; 13 - filtro di chiarificazione stadio II; 14 - rilascio d'aria; 15 - filtro veloce con “carico a secco”; 16 - miscelatore; 17 - camera a vortice per flocculazione; 18 - vasca di decantazione a strato sottile; 19 - filtro prerivestimento
![]()

Riso. 17.4. Schemi per il trattamento delle acque sotterranee nel serbatoio.
a - Sistema “Hydrooxiring”, b - installazione a pozzo singolo; c - multi-pozzo. 1 - pozzo ausiliario, 2 - tubazione, 3 - dispositivo per l'aerazione dell'acqua, 4 - bacino di infiltrazione anulare, 5 - pozzo di produzione, 6 - zona di aerazione, 7 - drenaggio dell'acqua al consumatore, 8 - pompa, 9 - tubazione di approvvigionamento idrico al la vasca di raccolta, 10 - eiettore, 11 - tubazione di alimentazione dell'acqua dalla vasca di raccolta al pozzo, 12 - vasca di raccolta
La deferrizzazione dell'acqua per catione è consigliabile solo nei casi in cui, contemporaneamente alla deferrizzazione, è richiesto l'addolcimento dell'acqua e scambio ionico possono essere estratti solo gli ioni ferro (II).
Il metodo di aerazione semplificato (vedere Fig. 17.3, b) è applicabile sia nella versione a gravità che in quella a pressione, a seconda della produttività dell'impianto. In aggiunta a quanto sopra, indicatori dell'applicabilità di questo metodo sono condizioni in cui la E dell'acqua dopo l'aerazione è almeno +100 mV e l'indice di stabilità dell'acqua (J) è almeno +0,05. Il metodo di aerazione semplificato si basa sulla capacità dell'acqua contenente ferro bivalente e ossigeno disciolto, quando filtrata attraverso uno strato granulare, di rilasciare ferro sulla superficie dei grani, formando un film catalitico di ioni e ossidi di ferro bivalente e trivalente. Questo film intensifica attivamente il processo di ossidazione e rilascio di ferro dall'acqua. La deferrizzazione dell'acqua in una carica rivestita con film è un processo autocatalitico eterogeneo, che comporta un continuo rinnovamento del film come catalizzatore direttamente durante il funzionamento del filtro.
Questo metodo non richiede l'ossidazione del ferro ferroso in ferro ferrico e la sua conversione in idrossido, quindi non è necessaria l'installazione di costose strutture di aerazione. L'aerazione semplificata viene effettuata utilizzando semplici dispositivi versando acqua da una piccola altezza in una tasca o canale centrale del filtro, oppure soffiando aria nell'acqua da trattare. L'assenza di speciali dispositivi di aerazione e contenitori a contatto semplifica il funzionamento e riduce i costi di pulizia.
Per calcolare il carico del filtro per la deferrizzazione delle acque sotterranee bicarbonate e carbonatiche utilizzando il metodo di aerazione semplificato, la formula empirica di G.I. Nikoladze
![]() (17.1)
(17.1)
dove L è lo spessore dello strato del media filtrante: m; e -velocità di filtrazione, m/h; d3 - diametro equivalente del media filtrante, mm; L=SI/SF (qui SI e SP sono il contenuto di ferro (II), rispettivamente, nell'acqua di fonte e nel filtrato, mg/l); K è la costante di reazione per l'ossidazione del ferro (II), determinata empiricamente; a e n sono rispettivamente il coefficiente di forma dei grani e la porosità del media filtrante; t1 - temperatura dell'acqua della sorgente, °C; - contenuto di ossigeno disciolto nell'acqua, mg/l.
L'essenza del metodo di "filtrazione a secco" (vedere Fig. 17.3, d) è quella di filtrare un'emulsione aria-acqua attraverso un carico di filtro granulare "secco" (non allagato) creando un vuoto al suo interno o pompando grandi quantità di aria, seguito per aspirazione dallo spazio inferiore. In entrambi i casi, nei canali dei pori del media filtrante si forma un regime turbolento di movimento della miscela, caratterizzato da turbolenze e controcorrenti, che favorisce il contatto molecolare dell'acqua con la superficie dei grani della massa di contatto. Allo stesso tempo, sui grani del media filtrante si forma un film adsorbente-catalitico di composti del ferro (e del manganese, se presente in acqua), aumentando l'efficienza dei processi di demanganazione e deferrizzazione.
Caratteristica del processo è la formazione di una pellicola disidratata sui granuli di carico (sabbia, argilla espansa, antracite, plastica vinilica, polistirolo, polimetilmetacrilato, ecc.), costituita, come dimostrato dalle determinazioni ai raggi X, da magnetite, siderite , goethite ed ematite. Questi composti hanno una struttura densa ed il loro volume è 4...5 volte inferiore a quello dell'idrossido di ferro. Pertanto, il tasso di aumento della perdita di pressione nel mezzo filtrante durante la filtrazione a pressione utilizzando il metodo della “filtrazione a secco” è estremamente ridotto e la durata del ciclo di filtraggio è lunga (da diversi mesi a un anno o più). Caratteristiche peculiari processo sono: il periodo minimo di “carica” del media filtrante (ovvero la formazione di un film di adsorbimento attivo sulla superficie dei grani), che varia da 0,3 a 2 ore, un aumento del pH ed una leggera diminuzione della durezza del il filtrato, l'elevata capacità di trattenimento dello sporco dei mezzi e l'assenza di acqua di lavaggio (il carico lavato dai composti del ferro con una soluzione di ditianite allo 0,5...1% o sostituito con uno nuovo, può essere lavato con un 5...10 % soluzione di inibito di acido cloridrico). Nel filtrato si osservano solitamente ferro(II) e tracce di Fe(III). Durata, giorni. ciclo di filtraggio, un filtro che opera secondo lo schema della “filtrazione a secco”, secondo G. I. Nikoladze è pari a
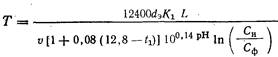
dove K1 è il rapporto aria-acqua. Per altre notazioni, vedere la formula (17.1).
Nella versione a pressione è preferibile utilizzare il metodo di aerazione semplificata con filtrazione a due stadi (Fig. 17.3, c). L'essenza del processo è simile a quella sopra descritta. All'inizio del processo di deferrizzazione, quando le prime porzioni di acqua entrano nel filtro, quando il carico è ancora pulito, l'adsorbimento dei composti di ferro sulla sua superficie avviene in uno strato monomolecolare, cioè l'adsorbimento fisico avviene a causa delle forze di attrazione tra le molecole dell'adsorbato e dell'adsorbente (superficie del corpo solido - l'adsorbente è saturo di molecole di adsorbato). Dopo la formazione di uno strato monomolecolare, il processo di rilascio dei composti di ferro sui granelli di sabbia non si ferma, ma, al contrario, si intensifica a causa del fatto che il monostrato risultante è chimicamente più attivo della superficie pulita della sabbia. Studi al microscopio elettronico del film hanno dimostrato che è costituito da molecole sferiche di idrossido di ferro e altri composti, sia ferro (III) che ferro (II). La quantità di acqua legata nel film raggiunge il 20%. La superficie effettiva del film è di almeno 200 m2/g.
Proprietà di adsorbimento di un film di composti del ferro sui grani del media filtrante, sua elevata superficie specifica e presenza grande quantità l'acqua legata porta alla conclusione che il film è un adsorbente molto forte struttura spugnosa. Allo stesso tempo, il film funge da catalizzatore per l’ossidazione del ferro(II) che entra nella carica. A questo proposito, l'effetto della depurazione dell'acqua con uno strato granulare è incomparabilmente maggiore di quanto potrebbe essere in un ambiente omogeneo.
Per un catalizzatore di questo tipo, alcune sostanze presenti nell'acqua (ammoniaca, idrogeno solforato, anidride carbonica libera, acido silicico colloidale) sono “veleni”. Le molecole di queste sostanze hanno ciascuna una coppia di elettroni liberi, che possono partecipare alla formazione di legami covalenti con la superficie del catalizzatore, che, a concentrazioni significative di questi composti, porta ad una diminuzione della sua attività.
Il processo è descritto dalla seguente equazione:
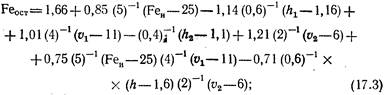
dove Feosity FeH è, rispettivamente, il contenuto di ferro nel filtrato del filtro di II stadio e nell'acqua trattata, mg/l; h1 e h2 sono le altezze degli strati del mezzo filtrante rispettivamente sui filtri di stadio I e II; v1 e i>2 sono le velocità di filtrazione rispettivamente sui filtri di stadio I e II.
Il metodo di filtrazione sui filtri a telaio deve essere utilizzato per la deferrizzazione dell'acqua in impianti con una capacità fino a 1000 m3/giorno. L'essenza della deferrizzazione dell'acqua secondo il metodo in esame è che il ferro (II) dopo l'ossidazione passa nel ferro precipitato (III). L'idrossido di ferro, formatosi nella parte inferiore dell'apparecchio, viene lavato sulla cartuccia. Allo stesso tempo, all'inizio del processo ruolo decisivo gioca una differenza nelle cariche della cartuccia ceramica, delle scaglie di idrossido di ferro e degli ioni ferro (II). Lo strato di idrossido di ferro che cresce sulla cartuccia funge da materiale di contatto per le nuove unità costantemente lavate, mentre si verificano sia processi fisici che chimici. La cartuccia serve solo come cascata di supporto per lo strato filtrante di idrossido di ferro.
Nella deferrizzazione delle acque naturali mediante filtri a cartuccia, la prima fase del processo è la filtrazione con graduale intasamento dei pori della membrana filtrante. Questa fase termina quando viene raggiunto un determinato rapporto volumetrico particolato, trattenuto nei pori, al volume dei pori stessi, dopodiché inizia la seconda fase: filtrazione con la formazione di uno strato iniziale di sedimento. Questo completa il processo di caricamento del filtro e inizia il filtraggio per rimuovere il ferro dall'acqua.
Le formule (17.4) e (17.5) permettono di determinare la quantità di filtrato Q, m3/h ottenuta da 1 m2 di superficie filtrante e la velocità di filtrazione v, m/h:
Q= 100(37,3-4,8υ-3,5) + 0,27 2 - l.67υ; (17.4)
Secondo G.I. Nikoladze, la durata del ciclo di filtraggio può essere determinata dall'espressione
dove Δр è la caduta di pressione durante la filtrazione; mt è la massa della fase solida trattenuta dal telaio del filtro quando riceve un volume unitario di filtrato; - contenuto di ferro nell'acqua trattata.
L'essenza del metodo di aerazione che utilizza dispositivi di espulsione sotto vuoto (Fig. 17.5) è l'ossidazione del ferro(II) da parte dell'ossigeno atmosferico in ossido che forma un colloide di idrossido di ferro, la sua coagulazione a pH = 6,8...7 e la precipitazione nel forma di scaglie marroni. Quando l'acqua contenente ferro(II) entra in contatto con l'aria, l'ossigeno si dissolve nell'acqua, il potenziale di ossidazione del sistema aumenta e se si creano le condizioni per rimuovere parte dell'anidride carbonica disciolta, il pH del sistema aumenterà fino a valore che garantisce, a un dato potenziale di ossidazione, la precipitazione dell'idrossido di ferro (III).
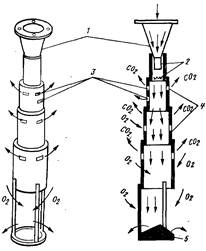
Riso. 17.5. Dispositivo di espulsione a vuoto.
UN - forma generale; b - sezione lungo l'asse dell'apparecchio; I - sedimento conico convergente; 2 - camera a vuoto; 3 - finestre per l'aspirazione dell'aria e la rimozione dell'anidride carbonica; 4 - camere di espulsione; 5 - piastra riflettente (opzione)
Quando si utilizzano chiarificatori con uno strato di sedimento sospeso in questo schema, il processo secondo G.I. Nikoladze è descritto dalla seguente equazione:
dove Fe0 e FeH sono, rispettivamente, il contenuto di ferro nell'acqua dopo il chiarificatore e nell'acqua trattata, mg/l; b- coefficiente sperimentale dipendente dalle proprietà dell'acqua, h-1; I - Altezza dello strato sospeso, m; v è la velocità di movimento verso l'alto dell'acqua nello strato sospeso, m/h; n è un esponente che tiene conto dell'influenza dell'ossidazione del ferro(II) sull'effetto della rimozione del ferro nell'acqua.
La deferrizzazione dell'acqua mediante filtrazione attraverso un mezzo modificato si basa sull'aumento delle forze di adesione influenzando la struttura molecolare della superficie dei grani del mezzo filtrante. Per aumentare le forze di adesione, come hanno dimostrato gli studi, è necessario formare un film di composti con più alto valore costanti di van der Waals. Inoltre, le proprietà elettrostatiche di questi composti dovrebbero garantire una variazione del potenziale zeta della superficie del grano nella direzione desiderata. In questo caso, maggiore è il peso molecolare, maggiore è la forza di adesione tra le superfici a contatto.
Il metodo per modificare il carico prevede il suo trattamento sequenziale con una soluzione all'1,5% di solfato di ferro (II) e quindi con una soluzione allo 0,5% di permanganato di potassio. La durata totale del contatto è di 30 minuti. 20 minuti dopo l'inizio del lavoro, il filtrato soddisfa i limiti di GOST 2874-82. "Bevendo acqua".
La deferrizzazione dell'acqua mediante aerazione, clorazione e filtrazione semplificate consiste nel rimuovere l'anidride carbonica in eccesso e nell'arricchire l'acqua con ossigeno durante l'aerazione, che contribuisce ad un aumento del pH e all'ossidazione primaria dei composti organoferon. La distruzione finale dei composti complessi del ferro (II) e la sua parziale ossidazione si ottiene introducendo nell'acqua trattata un agente ossidante (cloro, ozono, permanganato di potassio, ecc.). I composti ferrosi e gli ossidi di ferro vengono estratti dall'acqua quando questa viene filtrata attraverso un carico granulare.
Il cloro viene immesso nel letto ad acqua attraverso uno speciale sistema tubolare di distribuzione; è necessario garantire tempo richiesto contatto dell'agente ossidante con l'acqua trattata. Come dispositivo di filtraggio si consigliano i filtri a contatto KF-5 con maggiore capacità di trattenere lo sporco. Nel filtro a contatto KF-5, il media filtrante è costituito da tre strati di 0,6 m di spessore: lo strato superiore è argilla espansa o polimeri con una granulometria di 2,3...3,3 mm, lo strato intermedio è antracite o scorie d'altoforno con un granulometria di 1,25...2,3 mm, lo strato inferiore è sabbia di quarzo o rocce bruciate con grani di 0,8...1,25 mm. Velocità di filtrazione 7 m/h, risciacquo con acqua.
La deferrizzazione mediante flottazione a pressione si basa sull'azione di forze molecolari che favoriscono l'adesione delle singole particelle di idrossido di ferro con bolle d'aria finemente disperse nell'acqua e il galleggiamento degli aggregati risultanti alla superficie dell'acqua. Il metodo di separazione per flottazione delle impurità disperse e colloidali delle acque naturali è molto promettente grazie alla forte riduzione della durata del processo (3...4 volte) rispetto alla sedimentazione o alla lavorazione in uno strato di sedimento sospeso.
Il processo di separazione per flottazione a pressione delle scaglie di idrossido di ferro può essere suddiviso in fasi successive: ossidazione del ferro ferroso in ossido di ferro, dissoluzione dell'aria in acqua e formazione di bolle; la formazione di complessi “bolle d'aria - scaglie di idrossido di ferro” e la risalita di questi complessi sulla superficie dell'acqua. Ogni fase ha un impatto significativo sull’efficienza e sull’economia del processo.
L'efficienza del processo di galleggiamento delle scaglie durante la separazione per flottazione è influenzata dalla concentrazione dei solidi sospesi (concentrazione iniziale di ferro, dose di calce), dal numero e dalla dimensione delle bolle, dalla durata della flottazione, nonché dalle condizioni idrodinamiche. L'effetto di flottazione può essere determinato dalla formula
dove up è il tasso di crescita della bolla; T è la durata della permanenza dell'acqua nel galleggiante; P è il numero di bolle d'aria per unità di volume d'acqua; H0 è l'altezza dello strato d'acqua nel flottatore; a è il coefficiente di probabilità della fissazione di bolle sul cotone di idrossido di ferro quando viene sollevato di 1 cm.
Con l'aumento della durata della flottazione, della pressione nel serbatoio a pressione, della dose di calce, nonché del contenuto iniziale di ferro, l'effetto della deferrizzazione aumenta e con l'aumento della quantità di acqua di dispersione diminuisce. Altri fattori, come mostrano le equazioni di regressione, non hanno un impatto significativo.
dove T è la durata della permanenza dell'acqua nel galleggiante, min; (/ - quantità di acqua sottoposta a saturazione con aria, l; Di - dose di calce, mg/"l; p - pressione di saturazione, MPa; Fe„ - concentrazione iniziale di ferro, mg/l; E - effetto di deferrizzazione; Ok, ossidabilità.
La riduzione dell'ossidazione dipende principalmente dalla quantità di acqua esposta alla saturazione dell'aria, dalla dose di calce e dalla pressione di saturazione.
La rimozione delle forme stabili altamente concentrate di ferro dall'acqua mediante aerazione, calcinazione, sedimentazione in uno strato sottile e filtrazione si ottiene dopo la completa ossidazione del ferro (II) e la distruzione dei composti organoferronici complessi a pH≥7.l. Il processo di separazione dei composti del ferro in una vasca di sedimentazione a strato sottile è di natura ciclica e l'effetto della rimozione del ferro dall'acqua dipende principalmente dalla portata nei moduli a strato sottile, dalla concentrazione iniziale di ferro e dalla dose dell'acido alcalino reagente. Per agglomerare le scaglie di idrossido di ferro sedimentanti nel decantatore, il volume della camera di flocculazione del tipo a vortice abbinata al decantatore deve garantire un tempo di permanenza dell'acqua trattata di almeno 15 minuti.
L'effetto della deferizzazione dell'acqua E, %, ottenuto nei moduli a strato sottile, dipende dalla velocità del flusso - v, dalla dose del reagente alcalino - Di, dal contenuto di ferro nell'acqua trattata - FeH ed è descritto dall'equazione
E = 32,23 + 0,33υ - 0,224υ2 + 1,28DI-0,007D2 + 0,37FeH. (17.11)
La velocità del movimento dell'acqua nei moduli a strato sottile secondo G.I. Nikoladze
dove l è la lunghezza della cella del decantatore, m; υcr - velocità critica del flusso nel serbatoio di decantazione, m/h; A0 è un parametro caratterizzante la concentrazione dei sedimenti depositati nella vasca di decantazione, g/l; F è un parametro funzionale che dipende principalmente dalla durata della compattazione dei fanghi e dal ciclo di sedimentazione, h; K è il contenuto di sostanze sospese insolubili nel reagente alcalino, mg/l; Fe0 - contenuto di ferro nell'acqua stabilizzata.
Fe0=FeH(1 - 0,01 Oe).(17.13)
flottazione dell'acqua di deferrizzazione
Per rimuovere il solfato di ferro (II), viene utilizzata la calcinazione, in cui la calce reagisce prima con il solfato di ferro (II):
FeS04 + Ca(OH)2 = CaS04 + Fe(OH)2.
L'idrossido di ferro (II) risultante viene ossidato a Fe(OH)3 e, se la quantità di ossigeno contenuta nell'acqua è insufficiente per l'ossidazione, contemporaneamente alla calcinazione viene eseguita la clorazione o l'aerazione dell'acqua.
Dose di calce (a Pe2+/28>SCI), mg/l
![]()
dove [CO2] è il contenuto di monossido di carbonio libero (IV) nell'acqua, mg/l; - contenuto di ferro (II) nell'acqua, mg/l; in\ - massa equivalente di sostanza coagulante anidra, mg/mg-eq; L'alcalinità è l'alcalinità dell'acqua di fonte, mEq/l.
La dose di cloro o candeggina è determinata dalla formula Dhl = 0,7[Fe2+], mg/l, e la dose di permanganato di potassio dalla formula Dp.m =, mg/l.
In alcuni casi vengono utilizzati catalizzatori per la rapida ossidazione del ferro(II), anche a bassi valori di pH. Solitamente vengono utilizzate come tali la pirolusite frantumata, la “sabbia nera” (sabbia ricoperta da una pellicola di ossidi di manganese, che si forma a seguito della decomposizione di una soluzione all'1% di permanganato di potassio, alcalinizzata a pH = 8,5...9). catalizzatori soluzione acquosa ammoniaca) e carbone solfonato rivestito da una pellicola di ossidi di manganese. Per ottenere quest'ultimo, il carbone solfonato viene trattato con una soluzione al 10% di MnCl2, quindi una soluzione all'1% di KMnO4 viene filtrata attraverso uno strato dello scambiatore cationico Mn risultante. Il potassio sostituisce il manganese, che viene ossidato e depositato sulla superficie del carbone sotto forma di una pellicola di ossidi di manganese. In questi casi, per ossidare il ferro (II), è necessario filtrare l'acqua ad una velocità di 10 m/h attraverso uno strato catalizzatore di 1 m di spessore.
Il processo di ossidazione del ferro (II) da parte di ossidi superiori di manganese, che vengono ridotti a stadi di ossidazione inferiori e poi nuovamente ossidati dall'ossigeno disciolto in acqua, è descritto dalle equazioni:
4Fe (HC03)2 + 3Mn02 + 2H20 -> 4Fe(OH)3 + MnO+ Mn203 + 8C02, 3МnО + 2KMn04 + H20 -> 5Mn02 + 2KOH,
ZMn203 + 2KMn04 + N20 -> 8Mn02 + 2KON.
La deferrizzazione dell'acqua mediante cationizzazione può essere utilizzata quando è necessario rimuovere contemporaneamente sali di ferro e sali che causano durezza e quando nell'acqua trattata non è presente ossigeno.
La deferrizzazione delle acque superficiali viene effettuata con contemporanea chiarificazione e decolorazione. Il ferro, presente nell'acqua sotto forma di colloidi, sospensioni fini e composti complessi, viene rimosso trattando l'acqua con coagulanti [solfato di alluminio, cloruro di ferro (III) o un coagulante misto]. Per distruggere i composti organici complessi del ferro, l'acqua viene trattata con cloro, ozono o permanganato di potassio. Quando si usano coagulanti del ferro, di più rimozione completa ferro dall'acqua come risultato dell'intenso adsorbimento di ioni ferro sulle scaglie Fe(OH)3. L'assorbimento ottimale degli ioni ferro, sia nel caso di utilizzo di coagulanti di alluminio che di ferro, rientra nell'intervallo di valori di pH dell'acqua 5,7...7,5. La dose del coagulante viene determinata sperimentalmente. Sistema tecnologico la deferrizzazione dell'acqua utilizzando il metodo della coagulazione comprende strutture per reagenti, miscelatori, chiarificatori e filtri.
L'Istituto di Chimica Generale e Inorganica dell'Accademia delle Scienze dell'Ucraina ha sviluppato un metodo per deferrizzare l'acqua utilizzando alluminato di sodio e cloruro di ferro (III). Questo metodo rimuove il ferro presente nell'acqua sotto forma di composti inorganici e organici (humus). Allo stesso tempo vengono eliminati l'acido silicico colloidale, il manganese, le sostanze inorganiche sospese e le sostanze organiche. Il rapporto ottimale tra FeCl3 e NaA102 è 1:1. Il contenuto residuo di ferro nell'acqua non supera gli standard stabiliti per bevendo acqua. Inoltre, è stato sviluppato un metodo per rimuovere il ferro dall'acqua filtrando attraverso uno strato sospeso di gesso fine e idrossido di alluminio. I sali di ferro vengono convertiti dal gesso in carbonato di ferro (II), che si idrolizza in idrossido di ferro (III). L'idrossido di ferro (III) viene trattenuto nello strato sospeso. L'intero complesso di reazioni che si verificano può essere espresso dall'equazione
4CaC03+ 4FeS04 + 02 + 6H20 = 4Fe(OH)3 + 4CaS04 + 4C02
Il rapporto ottimale dei componenti principali è A1(0Н)з/ /CaС0з=0,16. La velocità stimata del flusso ascendente attraverso lo strato di gesso sospeso raggiunge 0,48 mm/s. La concentrazione di gesso nello strato sospeso è 0,02...0,03 g/cm3. Questo metodo rimuove fino al 95% del ferro totale presente nell'acqua.
Gli idrossidi di ferro vengono estratti più efficacemente dall'acqua nei chiarificatori con uno strato di mezzo di contatto sospeso. Grazie al processo catalitico eterogeneo, il ferro(II) nello strato di mezzo di contatto sospeso viene ossidato più velocemente. L'effetto della deferrizzazione è influenzato dal pH; temperatura, concentrazione iniziale di ferro, altezza dello strato di sedimenti e portata dell'acqua verso l'alto. Per la coagulazione senza calcinaio questa velocità è considerata pari a 0,8 mm/s, con calcinaio - 1,0 mm/s. L'altezza dello strato di mezzo di contatto sospeso nel chiarificatore è considerata pari a 2 m, l'altezza dello strato protettivo di acqua sopra il sedimento è di 1,5 m Il volume del compattatore di sedimenti nel chiarificatore deve garantire che il sedimento rimanga al suo interno per 6 ore.La quantità di acqua aspirata nel compattatore di sedimenti è del 20...30%.
I filtri rapidi a uno e due strati vengono utilizzati negli impianti di deferrizzazione. Con una granulometria di 0,6...1,2 mm, lo spessore dello strato filtrante è compreso tra 1,0 e 1,5 m. La velocità di filtrazione sui filtri veloci è 5...7 e sui filtri a doppio strato - su a 10 m/h. Per la pulizia degli strati filtranti viene utilizzato il lavaggio acqua-aria, integrato dal lavaggio superiore.
LETTERATURA
1. Alekseev L.S., Gladkov V.A. Migliorare la qualità delle acque dolci. M., Stroyizdat, 1994
2. Alferova L.A., Nechaev A.P. Sistemi idrici chiusi di imprese industriali, complessi e distretti. M., 1984.
3. Ayukaev R.I., Meltser V.3. Produzione e utilizzo di materiali filtranti per la depurazione dell'acqua. L., 1985.
4. Weitzer Yu.M., Miits D.M. Flocculanti ad alto peso molecolare nei processi di depurazione delle acque. M., 1984.
5. Egorov A.I. Idraulica dei sistemi tubolari a pressione negli impianti di trattamento delle acque. M., 1984.
6. Zhurba M.G. Depurazione dell'acqua mediante filtri granulari. Leopoli, 1980.
Deferrizzazione— rimuovere ferro e manganese dall'acqua è un compito difficile per la vita quotidiana e la produzione. Non esiste un metodo universale per tutti i casi che sia economicamente giustificato in tutti i siti. Se esistesse, sapremmo tutto di lui. Tuttavia, esistono molti metodi e ognuno di essi è applicabile entro certi limiti e, ovviamente, presenta i suoi inconvenienti. La maggior parte delle persone mi scrive: “Paul, c’è del ferro nell’acqua. Offerta delle aziende metodi diversi da 30 a 150 mila rubli. A chi credere? Cosa fare?"
 Valvola di controllo deferrizzatore
Valvola di controllo deferrizzatore Installare sopra il filtro
La valvola di controllo è un sistema di canali attraverso i quali si muove l'acqua, un meccanismo di bloccaggio che dirige l'acqua lungo il canale richiesto in questa fase del ciclo e un'unità di controllo elettrica per una valvola automatica o una maniglia per la commutazione manuale delle modalità per una valvola manuale valvola di controllo.
I filtri sono a tre cicli per i deferrizzatori senza reagenti o a cinque cicli per il lavaggio dei reagenti. Il lavaggio del reagente non consiste semplicemente nell'allentare la carica, ma nel far passare un reagente (ad esempio, una soluzione di permanganato di potassio) attraverso la carica per pulire profondamente la carica e ripristinare le sue proprietà catalitiche.
Cambiando modalità tramite una manopola o automaticamente utilizzando un'unità di controllo elettronica, organizziamo il lavaggio del filtro.
Durante il lavaggio del filtro, l'acqua non scorre al consumatore, ma viene gettata nel sistema di drenaggio.
Il lavaggio avviene in più fasi, ciascuna con la propria sfumature importanti. Consiglio di studiare
Dopo aver completato il lavaggio successivo, il filtro è nuovamente pronto per l'uso. Caricando un filtro con un funzionamento corretto di solito “vive” (funziona) per 3-5 anni.
Ossidazione e filtrazione con pirolusite (MnO2).
Questo metodo è eccellente per rimuovere piccole quantità di ferro ferroso Fe(OH)3 in condizioni semplici e per un basso consumo di acqua. pH elevato, mancanza di sostanze organiche e idrogeno solforato nell'acqua - prerequisiti. L'essenza del metodo è che ossidiamo il ferro utilizzando un magico componente di caricamento del filtro senza aerazione, senza dosaggio, senza ozono, senza reagenti - solo un deferrizzatore con caricamento: assorbente + pirolusite.
Pirolusiteè un minerale naturale. Biossido di manganese. Viene utilizzato per la produzione batterie. Da esso si ottiene il permanganato di potassio (KMnO 4) e in generale è abbastanza ampiamente utilizzato industria chimica. Nel trattamento dell'acqua, la pirolusite MnO2 viene utilizzata come materiale catalitico per la rimozione di ferro, manganese, composti organici, idrogeno solforato, perché la pirolusite è un buon agente ossidante.
Pirolusite nel trattamento delle acque- il materiale è unico. Quasi tutti i materiali catalitici sono realizzati utilizzando pirolusite:
BIRM è un alluminosilicato leggero e poroso complesso con pirolusite applicata come strato catalitico esterno. L’idea è fantastica, ma dura poco e ha paura dei prodotti organici.
Greensand Plus è sabbia di quarzo con pirolusite applicata sulla superficie dei granelli. Funziona solo con dosaggio costante di ipoclorito o lavaggio con permanganato di potassio.
MZhF, MSK, Pyrolox, Sorbent MS e molti altri materiali, tutti realizzati con pirolusite.
 Deferrizzatore a base di pirolusite. L'ammorbidente è un'opzione. Potrebbe non esistere.
Deferrizzatore a base di pirolusite. L'ammorbidente è un'opzione. Potrebbe non esistere. In cui pirolusiteè un minerale contenente il 75-95% MnO2, viene fornito granulato, di frazione idonea. Economico, ma molto pesante. Per sciacquarlo è necessario un flusso d'acqua veloce. Maggiore è il diametro della colonna, maggiore è la pressione richiesta nel sistema per creare un flusso alla velocità richiesta per liquefare la carica.
Tuttavia, la pirolusite può essere utilizzata come additivo reagente all'assorbente MS per rimuovere piccole quantità di ferro e manganese senza ossidazione. Hai una colonna: un deferrizzatore con caricamento - assorbente + pirolusite. Nessun reagente. Nessuna aerazione o altro tipo di agente ossidante. Questo sistema è in qualche modo unico. Nessun altro materiale tranne la pirolusite è in grado di ossidare i metalli disciolti in acqua per anni senza ossidazione attiva o rigenerazione dei reagenti. Perché non utilizziamo prodotti contenenti pirolusite (BIRM, Greensand, MZhF, ecc.), ma proprio la pirolusite stessa. Durante il funzionamento praticamente non si consuma, può “spolverare” un po' - produrre acqua grigia - una volta usurato, viene lavato nella rete idrica in modalità filtrazione, ma questo vale non solo per la pirolusite, ma per tutti i carichi in generale. È possibile installare un filtro al carbone con una cartuccia all'uscita per evitare che le particelle di pirolusite entrino nella rete idrica e consiglio di installare un sistema ad osmosi inversa per ottenere acqua potabile in cucina, perché... con qualche condizioni supplementari la pirolusite può rilasciare manganese al consumatore, possibilmente superando leggermente l'MPC.
Condizioni per l'utilizzo della PYROLUSITE come ossidante del ferro:
- Ferro Fe(OH)2<3мг/л
- Manganese Mn2+<0,2мг/л
- pH >6,8
- Ossidabilità del permanganato<2
- Idrogeno solforato< 0,005
Se queste condizioni sono soddisfatte, consiglio di utilizzare la colonna 1354 per ottenere fino a 1,5 metri cubi di acqua pulita all'ora. Il filtro deve essere lavato ogni pochi giorni. Nel caso di una valvola manuale è accettabile prolungare il ciclo di lavaggio una volta alla settimana.
Costo del deferrizzatore a base di pirolusite
Scambio ionico (addolcimento)
Per rimuovere varie impurità dall'acqua, inclusi metalli disciolti e composti organici, da oltre 50 anni vengono utilizzate resine a scambio ionico: scambiatori cationici e scambiatori anionici in varie combinazioni, che richiedono la rigenerazione con sale da cucina NaCl in compresse.
Viene chiamato il processo di rimozione di sali e metalli mediante resine a scambio ionico ammorbidente. Inizialmente questo metodo veniva utilizzato ed è ora utilizzato principalmente per rimuovere i sali di durezza (sali di calcio e magnesio). Tuttavia, ora esiste un’ampia scelta di resine a scambio ionico per la rimozione del ferro e della materia organica.
Le resine a scambio ionico sono un argomento molto ampio. Stiamo parlando esclusivamente del trattamento dell'acqua domestica e ti dirò solo ciò che devi sapere sulle resine nell'ambito del nostro compito: purificare l'acqua in una casa privata o in una piccola industria dai metalli disciolti.
Cos'è la resina? Queste sono palline sintetiche realizzate con materiali polimerici. Sono molto piccoli, ce ne sono molti, sembrano piccoli pollock, caviale di luccio o “tobiko” - caviale di pesci volanti. Noi installatori di trattamento acque, anche per gioco, chiamiamo la resina “caviale” in gergo professionale.

L'essenza del processo ammorbidente fondamentalmente diverso da deferrizzazione. Le resine non ossidano né convertono le sostanze disciolte in forma solida per la successiva filtrazione, ma sostituiscono ("assorbono") le sostanze disciolte nell'acqua con cationi di sodio, che non conferiscono all'acqua una proprietà come la durezza. La saturazione salina totale dell'acqua rimane invariata o addirittura aumenta. Ciò dipende dal tipo di soluti che la resina assorbe.
Sulla base di quanto sopra, emerge un parametro importante delle resine a scambio ionico: lo scambio ionico contenitore in resina. La capacità della resina è simile alla capacità di una batteria elettrica. C'è una fornitura di sodio, che viene gradualmente consumata durante lo scambio ionico, riducendo così la capacità della resina di assorbire sostanze disciolte dall'acqua. Quando il sodio si esaurisce, termina anche la pulizia: l'acqua passa attraverso lo spessore della resina senza modificarne le proprietà.
Calcoliamo in anticipo il funzionamento dell'addolcitore in modo tale da rigenerare (risciacquare) la resina con una soluzione di sale da cucina prima che si verifichi una notevole diminuzione della capacità. Questo periodo è chiamato trattamento dell'acqua ciclo di filtraggio. Per informazioni sul calcolo della quantità di resina, sale per la rigenerazione e ciclo di filtraggio leggere l'articolo sull'addolcimento.
Download multicomponente come Ecotar, Ecomix, FeroSoft, APT-2, Ionofer con indici diversi A, B, C eccetera. sono progettati per la rimozione ionica di sali disciolti, metalli, composti organici, nonché di un'ampia gamma di altre sostanze: metalli pesanti, ioni ammonio, composti organoferronici, fosforo, calcio, silicio e molti altri.
Come ho già detto, la resina viene rigenerata utilizzando sale da cucina in compresse NaCl, il sale viene venduto in tutti i mercati edili, nei negozi di idraulica, costa circa 7 dollari per un sacco da 30 kg. Il consumo di sale è determinato principalmente dalla quantità di sostanze rimosse.
In media, circa 1 sacco di sale al mese viene speso per l'addolcimento dell'acqua.
Osmosi inversa.
I sistemi ad osmosi inversa sono un metodo fondamentalmente diverso di purificazione dell'acqua. Qui si tratta di filtrare l'acqua attraverso una membrana. In parole povere, questa è una rete attraverso la quale passano le molecole d'acqua, ma non passano le molecole dei sali di durezza e dei metalli disciolti. In questo caso le molecole trattenute non formano un sedimento sulla superficie della membrana, ma vengono immediatamente drenate nel sistema fognario. Durante il processo di filtrazione ad osmosi inversa, l'acqua viene divisa in due flussi: permeare(purificato) e concentrarsi(acqua sporca) .
In media per 1 metro cubo. Con l'acqua purificata otteniamo un metro e mezzo cubo di concentrato, che deve essere drenato da qualche parte.
I sistemi ad osmosi inversa sono efficaci nella rimozione dei metalli disciolti e dei sali di durezza. Non sostituiscono alcune sostanze con altre, come le resine a scambio ionico, ma anzi purificano l'acqua dalle impurità, questo è un enorme vantaggio dell'osmosi inversa. Ma questo è forse il processo di trattamento dell'acqua più costoso e, per ragioni di opportunità, è il meno utilizzato per rimuovere ferro e manganese disciolti.
Tuttavia, con contenuti elevati di ferro ferroso Fe2+ disciolto e pH basso<7 осмос может быть весьма эффективен для удаления 20 и выше мг, потому что молекулы железа гораздо крупнее пор мембраны — их легко фильтровать.
dillo agli amici




