Ferro nella formula chimica del corpo. Ferro: struttura atomica, distribuzione in natura. Proprietà fisiche e chimiche del ferro
Il ferro è un elemento metallico del sottogruppo secondario VIII del gruppo 4 della tavola periodica elementi chimici. È un rappresentante degli elementi D. Il livello energetico esterno dell'atomo di ferro contiene due elettroni s
E al livello energetico superiore, il sottolivello D è pieno. Nei suoi composti, Ferum è in grado di presentare stati di ossidazione +2 e +3.
Frazione di massa del ferro in la crosta terrestreè del 5%. È al quarto posto per prevalenza in natura. I minerali di ferro più importanti sono: magnetite Fe3O4, ematite Fe2O3, limonite - Fe2O3 nH2O, siderite FeCO3, pirite FeS2.
Il ferro è biologicamente elemento importante. Si trova nel corpo di tutti gli animali e le piante. Il ferro fa parte del citoplasma delle piante ed è coinvolto nel processo di fotosintesi. Il corpo umano adulto contiene circa 4 g di ferro. Si accumula principalmente nel fegato, nel midollo osseo e nella milza. Ma la parte principale del ferro fa parte dell'emoglobina - il pigmento rosso del sangue, che svolge la funzione di trasportare l'ossigeno dai polmoni ai tessuti e nella direzione opposta - diossido di carbonio. La carenza di ferro porta a malattia pericolosa- anemia. Pertanto, devi assolutamente usarlo prodotti alimentari, ricco di Ferum: prezzemolo, fegato, vitello, grano saraceno, albicocche secche, ecc.
Il ferro puro è un metallo lucido bianco-argenteo con un punto di fusione di 1535? C e densità 7,87 g/cm3. Il ferro differisce dagli altri metalli proprietà magnetiche. Il ferro è un metallo molto duttile e può essere facilmente lavorato.
Il ferro è uno dei metalli ad attività media. Il ferro chimicamente puro è resistente alla corrosione. Tuttavia, quantità insignificanti di impurità lo privano di questa proprietà.
Il ferro brucia nell'ossigeno. Il prodotto di questa reazione è l'arrosto di ferro:
3Fe + 2O2 = Fe3O4.
Il ferro reagisce anche con altri non metalli: alogeni, zolfo, carbonio. Quando si interagisce con forti agenti ossidanti, ad esempio, il cloro produce composti di ferro con uno stato di ossidazione pari a +3:
2Fe + 3Сl2 = 2FeCl3,
e quando interagiscono con agenti ossidanti meno attivi, si formano composti con lo stato di ossidazione del ferro +2:
A alta temperatura il ferro reagisce con il vapore acqueo. Come risultato della reazione si formano ossido di ferro e idrogeno:
3Fe + 4H2O Fe3O4 + 4H2?.
Il ferro reagisce con soluzioni acide per formare sali e rilasciare gas idrogeno:
Fe + H2SO4 = FeSO4 + H2?.
Sotto l'influenza di solforico concentrato e acidi nitrici sulla superficie del ferro si forma una densa pellicola di ossido, perché questi acidi concentrati possono essere immagazzinati e trasportati in serbatoi di acciaio.
Il ferro sostituisce i metalli meno attivi quando interagiscono con le soluzioni dei loro sali:
Fe + CuSO4 = FeSO4 + Cu.
Nell'aria umida, il ferro si corrode. Il suo prodotto è la ruggine. A causa della sua porosità, la ruggine non impedisce l'accesso di ossigeno e umidità al metallo, il che porta ad un'ulteriore distruzione del metallo.
Il ferro è il metallo più importante tecnologia moderna. IN forma pura Il ferro non viene quasi mai utilizzato, ma circa il 90% dei metalli utilizzati dall'umanità sono leghe a base di ferro. Nel mondo viene fuso molto ferro, circa 50 volte più dell'alluminio, per non parlare degli altri metalli. Vengono create leghe a base di ferro che possono resistere all'esposizione ad alte e basse temperature, vuoto e alte pressioni, ambienti aggressivi, ecc. Le leghe di ferro sono ampiamente utilizzate come materiali strutturali e artistici.
Consideriamo struttura elettronica atomo di ferro e la sua posizione nella tavola periodica. Cerchiamo di identificare il fisico di base e Proprietà chimiche di questo elemento, ambito di utilizzo.
Posizione nel PS
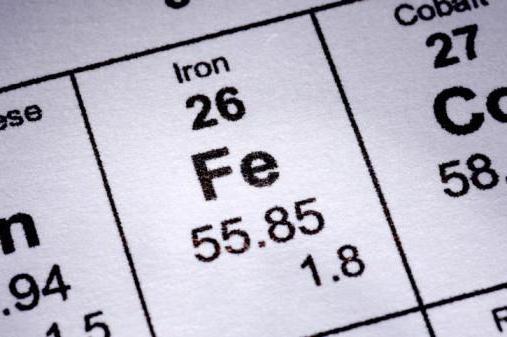
Il ferro è un elemento D del gruppo 8 (sottogruppo laterale). Ha un numero atomico di 26, una massa atomica relativa di 56 e il suo atomo contiene 26 protoni, 26 elettroni e 30 neutroni. Questo metallo ha una media attività chimica, mostre proprietà riparatrici. Stati di ossidazione caratteristici: +2, +3.
Caratteristiche della struttura dell'atomo
Cos'è un ferro da stiro elettronico? Se consideriamo la distribuzione degli elettroni sopra livelli di energia, otteniamo la seguente opzione:
2e; 8e; 14; 2e. Questa struttura del guscio elettronico dell'atomo di ferro indica la sua posizione in un sottogruppo secondario e conferma la sua appartenenza alla famiglia d degli elementi.

Essere nella natura
Il ferro è uno degli elementi chimici più comuni in natura. Nella crosta terrestre percentualeè di circa il 5,1%. Solo tre elementi sono presenti in maggiore quantità nelle profondità del nostro pianeta: silicio, alluminio e ossigeno.
I minerali di ferro si trovano in diverse regioni della Terra. Gli alchimisti scoprirono composti di questo metallo nei terreni. Quando si produce ferro, vengono selezionati minerali in cui il suo contenuto supera il 30%.
Il minerale di ferro magnetico contiene circa il settantadue per cento di metallo. I principali depositi di magnetite si trovano nell'anomalia magnetica di Kursk e negli Urali meridionali. Nella pietra del sangue la percentuale di ferro raggiunge il 65%. L'ematite è stata scoperta nella regione di Krivoy Rog.

Importanza per piante e animali
Che ruolo gioca il ferro negli organismi viventi? La struttura dell'atomo spiega le sue proprietà riducenti. Questo elemento chimico fa parte dell'emoglobina, conferendole un caratteristico colore rosso. Circa tre grammi di ferro puro, la maggior parte che è incluso nell'emoglobina, si trova nel corpo di un adulto. Lo scopo principale è trasferire l'ossigeno attivo dai polmoni ai tessuti, nonché rimuovere l'anidride carbonica risultante.
Anche le piante hanno bisogno di questo metallo. Facendo parte del citoplasma, prende parte attiva ai processi di fotosintesi. Se la pianta non ha abbastanza ferro, le sue foglie sono bianche. Con una concimazione minima con sali di ferro, le foglie delle piante diventano verdi.
Proprietà fisiche
Abbiamo osservato la struttura dell'atomo di ferro. Il diagramma conferma che questo elemento ha una lucentezza metallica (sono presenti elettroni di valenza). Il metallo bianco-argenteo ha un punto di fusione abbastanza alto (1539 gradi Celsius). Grazie alla sua buona duttilità, questo metallo può essere facilmente laminato, stampato e forgiato.
La capacità di magnetizzare e smagnetizzare, caratteristica del ferro, lo ha reso un materiale eccellente per la produzione di nuclei di potenti elettromagneti in vari dispositivi e macchine elettriche.
Quanto è attivo il ferro? La struttura di un atomo mostra la presenza di livello esterno due elettroni che verranno ceduti durante reazione chimica. Per aumentarne la durezza e la resistenza, viene eseguita un'ulteriore laminazione e indurimento del metallo. Tali processi non sono accompagnati da un cambiamento nella struttura dell'atomo.

Tipi di ferro
Lo spiega la struttura elettronica dell'atomo di ferro, il cui diagramma è stato discusso sopra caratteristiche chimiche. Nel metallo commercialmente puro, ovvero l'acciaio a basso tenore di carbonio, il componente principale è il ferro. Circa lo 0,04% del carbonio è stato identificato come impurità erano presenti anche fosforo, azoto e zolfo;
Il ferro chimicamente puro è simile nei suoi parametri esterni al platino. Ha una maggiore resistenza ai processi di corrosione ed è resistente agli acidi. Con la minima introduzione di impurità in un metallo puro, le sue caratteristiche uniche scompaiono.
Opzioni di ricevuta
La struttura degli atomi di alluminio e ferro indica che l'alluminio anfotero appartiene al sottogruppo principale e la possibilità di utilizzarlo nel processo di separazione del ferro dai suoi ossidi. Alluminotermia, effettuata presso temperatura elevata, consente di isolare il metallo puro dai minerali naturali. Oltre all'alluminio, come forti agenti riducenti vengono scelti il carbonio (2) e il carbone.
Caratteristiche delle proprietà chimiche
Quali proprietà chimiche ha il ferro? La struttura di un atomo spiega la sua attività riducente. Il ferro è caratterizzato dalla formazione di due serie di composti aventi stati di ossidazione +2, +3.
In aria umida avviene il processo di arrugginimento (corrosione) del metallo, con conseguente formazione di idrossido di ferro (3). Il filo di ferro riscaldato reagisce con l'ossigeno per formare una polvere nera di ossido di ferro (2,3), chiamata ossido di ferro.
Ad alte temperature il metallo è in grado di interagire con il vapore acqueo formando un ossido misto. Il processo è accompagnato dal rilascio di idrogeno.
La reazione con i non metalli avviene solo quando i componenti di partenza vengono preriscaldati.
Il ferro può essere sciolto in acido solforico o cloridrico diluito senza preriscaldare la miscela. Solforico concentrato e acido cloridrico passivare questo metallo.
Quali altre proprietà chimiche ha il ferro? La struttura atomica di un dato elemento indica la sua attività media. Ciò è confermato dalla disposizione del ferro prima dell'idrogeno (H2) nella serie di tensioni. Di conseguenza, può spostare dai sali tutti i metalli situati a destra nella serie di Beketov. Pertanto, nella reazione con cloruro di rame (2), effettuata mediante riscaldamento, si libera rame puro e si ottiene una soluzione di cloruro di ferro (2).
 Aree di utilizzo
Aree di utilizzo
La maggior parte del ferro viene utilizzata nella produzione di ferro e acciaio. Nella ghisa, la percentuale di carbonio è del 3-4%, nell'acciaio - non più dell'1,4%. Questo non metallo agisce come un elemento che aumenta la forza della connessione. Inoltre, ha un effetto positivo sulle proprietà di corrosione delle leghe e aumenta la resistenza del materiale alle temperature elevate.
Gli additivi al vanadio sono necessari per aumentare la resistenza meccanica dell'acciaio. Il cromo aumenta la resistenza agli agenti chimici aggressivi.
Le proprietà ferromagnetiche di questo elemento chimico lo hanno reso popolare nelle installazioni industriali che includono elettromagneti. Inoltre, il ferro ha trovato il suo utilizzo nell'industria dei souvenir. Con esso vengono realizzati vari souvenir, come i magneti colorati per il frigorifero.
La resistenza e la malleabilità consentono di utilizzare il metallo per creare armature, vari tipi armi.
(3) utilizzato per purificare l'acqua dalle impurità. In medicina, l'elemento periodico 26 viene utilizzato nel trattamento di malattie come l'anemia. Se mancano i globuli rossi, affaticabilità veloce, la pelle diventa innaturale colore pallido. Gli integratori di ferro aiutano ad eliminare problema simile, riporta il corpo alla piena attività. Il ferro è di particolare importanza per l'attività ghiandola tiroidea, fegato. Per prevenire il verificarsi di problemi seri, è sufficiente consumare circa 20 mg di questo metallo al giorno.
Qui puoi scaricare una lezione sul tema: "Ferro. La posizione del ferro nella tavola periodica e la struttura del suo atomo. Presenza in natura. Proprietà fisiche e chimiche del ferro" per l'argomento: Chimica. Questo documento ti aiuterà a preparare materiale buono e di alta qualità per la lezione.
Data____________ Classe_______________
Soggetto: Ferro. La posizione del ferro nella tavola periodica e la struttura del suo atomo. Essere nella natura. Proprietà fisiche e chimiche del ferro .
Obiettivi della lezione: considerare la struttura elettronica dell'atomo di ferro; studiarne la chimica e Proprietà fisiche.
Progresso
1. Organizzare il tempo lezione.
2. Studio di nuovo materiale.
Il ferro è un elemento chimico
1. La posizione del ferro nella tavola periodica degli elementi chimici e la struttura del suo atomo
Gli acciai vengono utilizzati per realizzare macchine, varie materiali da costruzione, travi, lamiere, laminati, rotaie, utensili e molti altri prodotti. Per la produzione diverse varietà Nell'acciaio vengono utilizzati i cosiddetti additivi leganti, che sono vari metalli: Mn, Cr, Mo e altri, che migliorano la qualità dell'acciaio.
3. Consolidamento del materiale studiato
N. 1. Annotare le equazioni di reazione per la produzione di ferro dai suoi ossidi Fe 2 O 3 e Fe 3 O 4, utilizzando come agente riducente:
a) idrogeno;
b) alluminio;
c) monossido di carbonio (II).
Per ogni reazione, crea una bilancia elettronica.
N. 2. Effettuare trasformazioni secondo lo schema:
Fe 2 O 3 -> Fe - +H2O, t -> X - +CO, t -> Y - +HCl -> Z
Nominare i prodotti X, Y, Z?
4. Compiti a casa.
P.43, esercizi 1-3, problemi 1, 4 a pagina 136
(il cosiddetto ferro meteoritico, che contiene più del 90% di Fe). Nei composti con ossigeno e altri elementi, è ampiamente distribuito in molti minerali e minerali. È il terzo elemento più abbondante nella crosta terrestre (5,00%) (dopo silicio e alluminio); Si ritiene che il nucleo terrestre sia costituito principalmente da ferro. I minerali principali sono l'ematite (minerale di ferro rosso) Fe 2 O 3; limonite Fe 2 O 3 ·nH 2 O (n = 1 - 4), contenuta, ad esempio, nel minerale di palude; magnetite (minerale di ferro magnetico) Fe 3 O 4 e siderite FeCO 3 . Il minerale di ferro più comune, sebbene non sia la fonte della sua produzione, è la pirite (pirite di zolfo, pirite di ferro) FeS 2, che a volte viene chiamata oro degli sciocchi o oro dei gatti per la sua lucentezza gialla, anche se in realtà spesso contiene piccole impurità di rame , oro , cobalto e altri metalli.
| PROPRIETÀ DEL FERRO | |
|---|---|
| Numero atomico | 26 |
| Massa atomica | 55,847 |
| Isotopi: | |
| stabile | 54, 56, 57, 58 |
| instabile | 52, 53, 55, 59 |
| Punto di fusione, °C | 1535 |
| Punto di ebollizione, °C | 3000 |
| Densità, g/cm3 | 7,87 |
| Durezza (Mohs) | 4,0-5,0 |
| Contenuto nella crosta terrestre,% (massa) | 5,00 |
| Stato di ossidazione: | |
| caratteristica | +2, +3 |
| altri significati | +1, +4, +6 |
Storia
Il ferro (elementare) è conosciuto e utilizzato fin dalla preistoria. I primi oggetti in ferro erano probabilmente realizzati con ferro meteoritico sotto forma di amuleti, gioielli e strumenti di lavoro. Circa 3.500 anni fa, l'uomo scoprì un modo per ridurre in metallo la terra rossa contenente ossido di ferro. Da allora, sono stati realizzati numerosi prodotti diversi in ferro. Ha svolto un ruolo importante nello sviluppo della cultura materiale dell'umanità. Al giorno d'oggi, il ferro viene principalmente (95%) fuso da minerali sotto forma di ghisa e acciaio e si ottiene in quantità relativamente piccole mediante riduzione di pellet metallizzati, mentre il ferro puro si ottiene dalla decomposizione termica dei suoi composti o dall'elettrolisi dei sali .
Proprietà
Il ferro metallico è una sostanza bianco-grigiastra, lucida, dura, plastica. Il ferro cristallizza in tre modifiche (α, γ, δ). α-Fe ha un reticolo cristallino cubico a corpo centrato, chimicamente stabile fino a 910°C. A 910°C l'α-Fe si trasforma in γ-Fe, stabile nell'intervallo 910-1400°C; Il γ-Fe cristallizza in un reticolo cristallino cubico a facce centrate. A temperature superiori a 1400°C il δ-Fe si forma con un reticolo sostanzialmente simile a quello dell'α-Fe. Il ferro è ferromagnetico; si magnetizza facilmente, ma perde le sue proprietà magnetiche quando il campo magnetico viene rimosso. Con l'aumentare della temperatura, le proprietà magnetiche del ferro si deteriorano e sopra i 769°C è praticamente impossibile magnetizzarsi (a volte il ferro nell'intervallo 769-910°C è chiamato -Fe); Il γ-Fe non è un materiale magnetico.
Utilizzo
Ferro- uno dei metalli più utili in una lega con carbonio (acciaio, ghisa) - una base ad alta resistenza per materiali strutturali. Essendo un materiale con proprietà magnetiche, il ferro viene utilizzato per i nuclei di elettromagneti e armature di macchine elettriche, nonché per strati e pellicole su nastri magnetici. Il ferro puro è un catalizzatore nei processi chimici, un componente medicinali in medicina.
Ferro come componente chimico del corpo
Il ferro è essenziale componente chimico organismi di molti vertebrati, invertebrati e alcune piante. Fa parte dell'emoglobina eme (pigmento degli eritrociti - globuli rossi) nel sangue, nel tessuto muscolare, midollo osseo, fegato e milza. Ogni molecola di emoglobina contiene 4 atomi di ferro, che sono in grado di creare un legame reversibile e debole con l'ossigeno, formando ossiemoglobina. Il sangue contenente ossiemoglobina circola in tutto il corpo, fornendo ossigeno ai tessuti per la respirazione cellulare. Pertanto, il ferro è necessario per la respirazione e la formazione dei globuli rossi. La mioglobina (o emoglobina muscolare) fornisce ossigeno ai muscoli. Totale stirare corpo umano(peso medio 70 kg) è di 3-5 g. Di questa quantità, il 65% del Fe è contenuto nell'emoglobina. Sono necessari da 10 a 20 mg di Fe al giorno per supportare il normale metabolismo dell'adulto medio. Carne rossa, uova, tuorlo, carote, frutta, grano e verdure verdi forniscono principalmente ferro al corpo quando alimentazione normale; per l'anemia associata alla mancanza di ferro nel corpo, prendi farmaci ghiandola.
Ferro come sostanza chimica elemento
Da un punto di vista chimico, il ferro è un metallo abbastanza attivo, che mostra stati di ossidazione caratteristici di +2, +3, meno spesso +1, +4, +6. Si combina direttamente con alcuni elementi, con S forma FeS - solfuro di ferro(III), con alogeni, eccetto lo iodio, - alogenuri di ferro(III), come FeCl 3. Facilmente ossidabile; con l'ossigeno produce ossidi FeO, Fe 2 O 3, Fe 3 O 4 (FeO + Fe 2 O 3), si corrode facilmente (arrugginisce). Sostituisce l'idrogeno dal vapore acqueo ad alte temperature. Si dissolve in acidi diluiti (ad esempio HCl, H 2 SO 4, HNO 3), spostando l'idrogeno e formando sali di Fe(II) (rispettivamente FeCl 2, FeSO 4, Fe(NO 3) 2). In H 2 SO 4 e HNO 3 moderatamente concentrati, il ferro si dissolve per formare sali di Fe (III), mentre in quelli altamente concentrati è passivato e non reagisce. La passività del ferro si spiega apparentemente con la formazione di una pellicola di ossido di ferro sulla sua superficie, che però si distrugge facilmente con il semplice raschiamento.
Corrosione del ferro
Ruggine del ferro (corrosione atmosferica del ferro)- questa è la sua ossidazione da parte dell'ossigeno atmosferico. La reazione avviene in presenza di ioni salini disciolti in acqua e ioni formati durante la dissociazione dell'acido carbonico, un prodotto dell'interazione tra anidride carbonica atmosferica e umidità. Di conseguenza, si forma ruggine rossa sciolta o ossido idrato con la composizione Fe 2 O 3 nH 2 O.
Connessioni
Connessioni complesse
| Elementi e materiali chimici |
||
|---|---|---|
| Elementi chimici | ||




