Железо в организме химическая формула. Железо: строение атома, распространение в природе. Физические и химические свойства железа
Железо - металлический элемент побочной подгруппы VИИИ группы 4 периода периодической системы химических элементов. Он является представителем d-элементов. На внешнем энергетическом уровне атома железа находится два s-электроны
А на передзовнишньому энергетическом уровне происходит заполнение d-подуровня. В своих соединениях Ферум способен проявлять степени окисления +2 и +3.
Массовая доля железа в земной коре составляет 5%. Он занимает четвертое место по распространенности в природе. Важнейшими железными рудами являются: магнетит Fе3О4, гематит Fe2О3, лимонитом - Fe2O3 nH2O, сидерит FеСО3, пирит FеS2.
Железо является биологически важным элементом. Он содержится в организмах всех животных и в растениях. Железо входит в состав цитоплазмы растений, участвует в процессе фотосинтеза. В организме взрослого человека содержится около 4 г железа. Он накапливается преимущественно в печени, костном мозге, селезенке. Но основная часть железа входит в состав гемоглобина - красного пигмента крови, который выполняет функцию переноса кислорода от легких к тканям, а в обратном направлении - углекислого газа. Недостаток железа приводит к опасной болезни - малокровие. Поэтому обязательно надо употреблять пищевые продукты, богатые Ферум: петрушку, печень, телятину, гречку, курагу и др..
Чистое железо - серебристо-белый блестящий металл с температурой плавления 1535 ? С и плотностью 7,87 г/см3. От других металлов железо отличается магнитными свойствами. Железо является очень пластичным металлом и легко поддается обработке.
Железо относится к числу металлов средней активности. Химически чистое железо устойчиво к коррозии. Однако ничтожные доли примесей лишают его этого свойства.
Железо сгорает в кислороде. Продукт этой реакции - железная ожарина:
3Fe + 2O2 = Fe3O4.
Железо реагирует и с другими неметаллами - галогенами, серой, углеродом. При взаимодействии с сильными окислителями, например, хлором образуются соединения железа со степенью окисления +3:
2Fe + 3Сl2 = 2FeCl3,
а при взаимодействии с менее активными окислителями образуются соединения со степенью окисления железа +2:
При высокой температуре железо реагирует с водяным паром. В результате реакции образуются железная ожарина и водород:
3Fe + 4H2O Fe3O4 + 4H2 ?.
Железо реагирует с растворами кислот с образованием солей и выделением газообразного водорода:
Fe + H2SO4 = FeSO4 + H2 ?.
Под действием концентрированных серной и азотной кислот на поверхности железа образуется плотная оксидная пленка, ибо эти концентрированные кислоты можно хранить и транспортировать в стальных цистернах.
Железо замещает менее активные металлы при взаимодействии с растворами их солей:
Fe + CuSO4 = FeSO4 + Cu.
На влажном воздухе железо подвергается коррозии. Ее продуктом является ржавчина. Вследствие своей пористости ржавчина не препятствует доступу кислорода и влаги к металлу, что приводит к дальнейшему разрушению металла.
Железо - важнейший металл современной техники. В чистом виде железо почти не используется, но примерно 90% металлов, используемых человечеством - это сплавы на основе железа. Железа выплавляется в мире очень много, примерно в 50 раз больше, чем алюминия, не говоря уже о других металлов. На основе железа создают сплавы, способные выдерживать воздействие высоких и низких температур, вакуума и высоких давлений, агрессивных сред и т.д.. Сплавы железа широко применяют как конструкционные и художественные материалы.
Рассмотрим электронное строение атома железа, а также его расположение в таблице Менделеева. Выявим основные физические и химические свойства данного элемента, области использования.
Положение в ПС
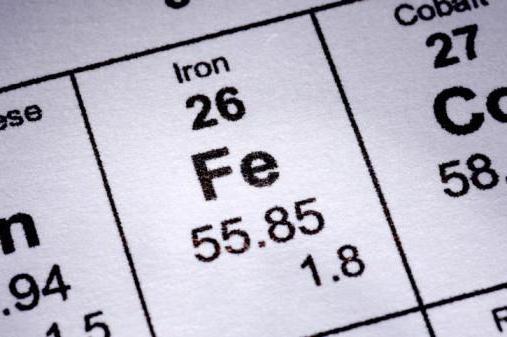
Железо является д-элементом 8 группы (побочной подгруппы). Имеет 26 порядковый номер, относительную атомную массу - 56, в его атоме содержится 26 протонов, 26 электронов, а также 30 нейтронов. Данный металл имеет среднюю химическую активность, проявляет восстановительные свойства. Характерные степени окисления: +2, +3.
Особенности строения атома
Что собой представляет электронная железа? Если рассматривать распределение электронов по энергетическим уровням, получим следующий вариант:
2е; 8е; 14 е; 2е. Такое строение электронной оболочки атома железа свидетельствует о его расположении в побочной подгруппе, подтверждает принадлежность к д-семейству элементов.

Нахождение в природе
Железо является одним из наиболее распространенных в природе химических элементов. В земной коре его процентное содержание составляет около 5,1%. В большем количестве в недрах нашей планеты присутствует только три элемента: кремний, алюминий, кислород.
Железные руды встречаются в разных регионах Земли. Алхимиками были обнаружены соединения данного металла в почвах. При производстве железа выбирают руды, в которых его содержание превышает 30 процентов.
В магнитном железняке содержится около семидесяти двух процентов металла. Основные месторождения магнетита располагаются в Курской магнитной аномалии, а также на Южном Урале. В кровавике процентное количество железа достигает 65 процентов. Гематит был обнаружен в Криворожском районе.

Значение для растений и животных
Какую роль в живых организмах выполняет железо? Строение атома поясняет его восстановительные свойства. Данный химический элемент входит в состав гемоглобина, придавая ему характерную красную окраску. Около трех граммов чистого железа, большая часть которого включена в гемоглобин, обнаружена в организме взрослого человека. Основным предназначением является перенос к тканям из легких активного кислорода, а также вывод образующегося углекислого газа.
Необходим этот металл и растениям. Входя в состав цитоплазмы, он принимает активное участие в процессах фотосинтеза. Если в растении недостаточно железа, его листья имеют белую окраску. При минимальных подкормках солями железа листья растений приобретают зеленый цвет.
Физические свойства
Мы рассмотрели строение атома железа. Схема подтверждает наличие у данного элемента металлического блеска (есть валентные электроны). У серебристо-белого металла довольно высокая температура плавления (1539 градусов по Цельсию). Благодаря хорошей пластичности данный металл легко поддается прокатке, штамповке, ковке.
Способность к намагничиванию и размагничиванию, характерная для железа, сделала его отличным материалом для производства сердечников мощных электромагнитов в разных аппаратах и электрических машинах.
Насколько активно железо? Строение атома показывает наличие на внешнем уровне двух электронов, которые будут отданы в ходе химической реакции. Для увеличения его твердости и прочности осуществляют дополнительную прокатку и закалку металла. Такие процессы не сопровождаются изменением строения атома.

Разновидности железа
Электронное строение атома железа, схема которого была рассмотрена выше, объясняет его химические характеристики. В технически чистом металле, являющемся низкоуглеродистой сталью, основным компонентом является железо. В качестве примесей выявлено около 0,04 процента углерода, также присутствуют фосфор, азот, сера.
Химически чистое железо по своим внешним параметрам аналогично платине. Оно обладает повышенной стойкостью к процессам коррозии, устойчиво к действию кислот. При малейшем введении примесей в чистый металл его уникальные характеристики исчезают.
Варианты получения
Строение атомов алюминия и железа свидетельствуют о принадлежности амфотерного алюминия к главной подгруппе, возможности использования его в процессе выделения железа из его оксидов. Алюмотермия, осуществляемая при повышенной температуре, позволяет выделять чистый металл из природных руд. Кроме алюминия в качестве сильных восстановителей выбирают углерода (2), уголь.
Особенности химических свойств
Какие химические свойства имеет железо? Строение атома поясняет его восстановительную активность. Для железа характерно образование двух рядов соединений, имеющих степени окисления +2, +3.
Во влажном воздухе происходит процесс ржавления (коррозии) металла, в результате образуется гидроксид железа (3). С кислородом нагретая железная проволока реагирует с появлением черного порошка оксида железа (2,3), называемого железной окалиной.
При высокой температуре металл способен взаимодействовать с парами воды, образуя при этом смешанный оксид. Процесс сопровождается выделением водорода.
Реакция с неметаллами происходит только при предварительном нагревании исходных компонентов.
Железо можно растворить в разбавленной серной или соляной кислотах без предварительного подогрева смеси. Концентрированные серная и соляная кислоты пассивируют этот металл.
Какими еще химическими свойствами обладает железо? Строение атома данного элемента свидетельствует о его средней активности. Это подтверждается расположением железа до водорода (Н2) в ряду напряжений. Следовательно, оно может вытеснять из солей все металлы, располагающиеся правее в ряду Бекетова. Так, в реакции с хлоридом меди (2), осуществляемой при нагревании, происходит выделение чистой меди и получение раствора хлорида железа (2).
 Области применения
Области применения
Основную часть всего железа используют в производстве чугуна и стали. В чугуне процентное содержание углерода составляет 3-4 процента, в стали - не больше 1,4 процентов. Этот неметалл выполняет функцию элемента, повышающего прочность соединения. Кроме того, он позитивно воздействует на коррозионные свойства сплавов, повышает устойчивость материала к повышенной температуре.
Добавки ванадия необходимы для повышения механической прочности стали. Хром увеличивает стойкость к действию агрессивных химических веществ.
Ферромагнитные свойства этого химического элемента сделали его востребованным в промышленных установках, включающих в состав электромагниты. Кроме того, железо нашло свое использование и в сувенирной промышленности. На его основе изготавливают различные сувениры, например красочные магнитики на холодильник.
Прочность и ковкость позволяют применять металл для создания брони, различных видов оружия.
(3) применяют для очистки воды от примесей. В медицине 26 элемент периодической применяют при лечении такого заболевания, как анемия. В случае недостатка красных кровяных телец возникает быстрая утомляемость, кожа приобретает неестественный бледный цвет. Препараты железа помогают устранять подобную проблему, возвращать организм к полноценной деятельности. Особое значение железо имеет для деятельности щитовидной железы, печени. Чтобы в организме человека не возникало серьезных проблем, достаточно употреблять в день около 20 мг этого металла.
Здесь Вы можете скачать Урок по теме: "Железо. Положение железа в периодической системе и строение его атома. Нахождение в природе. Физические и химические свойства железа" для предмета: Химия. Данный документ поможет вам подготовить хороший и качественный материал для урока.
Дата_____________ Класс_______________
Тема: Железо. Положение железа в периодической системе и строение его атома. Нахождение в природе. Физические и химические свойства железа .
Цели урока: рассмотреть электронное строение атома железа; изучить его химические и физические свойства.
Ход работы
1. Организационный момент урока.
2. Изучение нового материала.
Железо – химический элемент
1. Положение железа в периодической таблице химических элементов и строение его атома
Стали используются для изготовления машин, различных строительных материалов, балок, листов, проката, рельсов, инструмента и множества других изделий. Для производства различных сортов сталей применяют так называемые легирующие добавки, которыми служат различные металлы: Мn , Сr , Мо и другие, улучшающие качество стали.
3. Закрепление изученного материала
№1. Составьте уравнения реакций получения железа из его оксидов Fe 2 O 3 и Fe 3 O 4 , используя в качестве восстановителя:
а) водород;
б) алюминий;
в) оксид углерода (II).
Для каждой реакции составьте электронный баланс.
№2. Осуществите превращения по схеме:
Fe 2 O 3 -> Fe - +H2O, t -> X - +CO, t -> Y - +HCl -> Z
Назовите продукты X, Y, Z?
4. Домашнее задание.
П.43, упр.1-3, задачи 1, 4 на стр. 136
(т.н. метеоритное железо, которое содержит более 90% Fe). В соединениях с кислородом и другими элементами широко распространено в составе многих минералов и руд. По распространенности в земной коре (5,00%) это третий (после кремния и алюминия) элемент; считается, что земное ядро состоит в основном из железа. Основные минералы - гематит (красный железняк) Fe 2 O 3 ; лимонит Fe 2 O 3 ·nH 2 O (n = 1 - 4), содержащийся, например, в болотной руде; магнетит (магнитный железняк) Fe 3 O 4 и сидерит FeCO 3 . Наиболее распространенным минералом железа, не являющимся, однако, источником его получения, является пирит (серный колчедан, железный колчедан) FeS 2 , который иногда называют за его желтый блеск золотом дураков или кошачьим золотом , хотя он в действительности часто содержит небольшие примеси меди , золота , кобальта и других металлов.
| СВОЙСТВА ЖЕЛЕЗА | |
|---|---|
| Атомный номер | 26 |
| Атомная масса | 55,847 |
| Изотопы : | |
| стабильные | 54, 56, 57, 58 |
| нестабильные | 52, 53, 55, 59 |
| Температура плавления , °С | 1535 |
| Температура кипения , °С | 3000 |
| Плотность , г/см3 | 7,87 |
| Твердость (по Моосу) | 4,0-5,0 |
| Содержание в земной коре, % (масс.) | 5,00 |
| Степень окисления: | |
| характерная | +2, +3 |
| прочие значения | +1, +4, +6 |
История
Железо (элементное) известно и используется с доисторических времен. Первые изделия из железа, вероятно, были изготовлены из метеоритного железа в виде амулетов, драгоценностей и рабочего инструмента. Около 3500 лет назад человек открыл способ восстановления красной земли, содержащей оксид железа, в металл . С тех пор из железа было изготовлено огромное количество различных изделий. Оно сыграло важную роль в развитии материальной культуры человечества. В наши дни железо в основном (95%) выплавляют из руд в виде чугунов и сталей и в сравнительно небольших количествах получают восстановлением металлизованных окатышей, а чистое железо - термическим разложением его соединений или электролизом солей .
Свойства
Металлическое железо представляет собой серовато-белое блестящее твердое пластичное вещество. Железо кристаллизуется в трех модификациях (α, γ, δ). α-Fe имеет объемноцентрированную кубическую кристаллическую решетку , химически устойчиво до 910°С. При 910°С α-Fe переходит в γ-Fe, стабильное в интервале 910-1400°С; γ-Fe кристаллизуется в гранецентрированной кубической кристаллической решетке . При температуре выше 1400°С образуется δ-Fe с решеткой, в основном аналогичной решетке α-Fe. Железо - ферромагнетик, оно легко намагничивается, но теряет магнитные свойства при снятии магнитного поля . С повышением температуры магнитные свойства железа ухудшаются и выше 769°С оно практически не поддается намагничиванию (иногда железо в интервале 769-910°С называют &betta;-Fe); γ-Fe не является магнитным материалом.
Использование
Железо - один из самых пригодных к эксплуатации металлов в сплаве с углеродом (сталь , чугун) - высокопрочная основа конструкционных материалов. Как материал, обладающий магнитными свойствами, железо используется для сердечников электромагнитов и якорей электромашин, а также в качестве слоев и пленок на магнитных лентах. Чистое железо - катализатор в химических процессах, компонент лекарственных средств в медицине.
Железо как химический компонент организма
Железо является существенным химическим компонентом организмов многих позвоночных, беспозвоночных и некоторых растений. Оно входит в состав гема (пигмента эритроцитов - красных кровяных клеток) гемоглобина крови, мышечных тканей, костного мозга, печени и селезенки. Каждая молекула гемоглобина содержит 4 атома железа, которые способны создавать обратимую и непрочную связь с кислородом , образуя оксигемоглобин. Кровь, содержащая оксигемоглобин, циркулирует по телу, поставляя кислород к тканям для клеточного дыхания. Поэтому железо необходимо для дыхания и образования красных кровяных клеток. Миоглобин (или мышечный гемоглобин) снабжает кислородом мышцы. Общее количество железа в человеческом теле (средней массы 70 кг) составляет 3-5 г. Из этого количества 65% Fe находится в гемоглобине. От 10 до 20 мг Fe ежедневно требуется для обеспечения нормального метаболизма среднего взрослого. Красное мясо, яйца, желток, морковь, фрукты, любая пшеница и зеленые овощи в основном обеспечивают организм железом при нормальном питании; при анемии, связанной с недостатком железа в организме, принимают лекарственные препараты железа.
Железо как хим. элемент
С химической точки зрения железо - довольно активный металл , проявляет характерные степени окисления +2, +3, реже +1, +4, +6. Непосредственно соединяется с некоторыми элементами, с S образует FeS - сульфид железа(III), с галогенами , кроме иода , - галогениды железа(III), такие, как FeCl 3 . Легко окисляется; с кислородом дает оксиды FeO, Fe 2 O 3 , Fe 3 O 4 (FeO + Fe 2 O 3), легко корродирует (ржавеет). Вытесняет водород из паров воды при высокой температуре . Растворяется в разбавленных кислотах (например, HCl, H 2 SO 4 , HNO 3), вытесняя водород и образуя соли Fe(II) (соответственно FeCl 2 , FeSO 4 , Fe(NO 3) 2). В умеренно концентрированных H 2 SO 4 и HNO 3 железо растворяется с образованием солей Fe(III), а в сильноконцентрированных - пассивируется и не реагирует. Пассивность железа, по-видимому, объясняется образованием на его поверхности пленки оксида железа, которая, однако, легко разрушается при простом соскабливании.
Коррозия железа
Ржавление железа (атмосферная коррозия железа) - это окисление его кислородом воздуха . Реакция происходит в присутствии ионов солей , растворенных в воде , и ионов , образующихся при диссоциации угольной кислоты - продукта взаимодействия атмосферного углекислого газа и влаги . В результате образуется рыхлая ржавчина красного цвета, или гидратированный оксид состава Fe 2 O 3 ·nH 2 O.
Соединения
Комплексные соединения
| Химические элементы и материалы |
||
|---|---|---|
| Химические элементы | ||




