Реферат: Обезжелезивание природных вод
1.2. Методы обезжелезивания воды
Для обезжелезивания поверхностных вод используются только реагентные методы с последующей фильтрацией. Обезжелезивание подземных вод осуществляют фильтрованием в сочетании с одним из способов предварительной обработки воды:
- упрощенная аэрация,
- аэрация на специальных устройствах,
- коагуляция и осветление,
- введение реагентов-окислителей, таких как хлор, гипохлорит натрия или кальция, озон, перманганат калия;
При мотивированном обосновании применяют и другие методы, например катионирование, диализ, флотация, электрокоагуляция и др.
Для удаления из воды железа, содержащегося в виде коллоида гидроксида железа Fe(OH) 3 или в виде коллоидальных органических соединений, например гуматов железа, используют коагулирование сульфатом алюминия или железным купоросом с добавлением хлора или гипохлорита натрия.
В качестве наполнителей для фильтров в основном используют песок, антрацит, сульфоуголь, керамзит, пиролюзит, а также фильтрующие материалы, обработанные катализатором, ускоряющим процесс окисления двухвалентного железа в трехвалентное. В последнее время все большее распространение получают наполнители с каталитическими свойствами: Manganese Greensand (MGS), Birm, МТМ и МЖФ.
При наличии в воде коллоидного двухвалентного железа требуется проведение пробного обезжелезивания. Если отсутствует возможность осуществить его на первой стадии проектирования, выбирают один из вышеперечисленных методов на основании проведенного пробного обезжелезивания в лаборатории или опыта работы аналогичных установок.
Упрощенная аэрация
В процессе аэрации кислород воздуха окисляет двухвалентное железо, при этом из воды удаляется углекислота, что ускоряет процесс окисления и последующий гидролиз с образованием гидроксида железа.
Этот метод допускается применять при следующих качественных показателях воды :
- общее содержание железа до 10 мг/л, при этом содержание двухвалентного железа не менее 70%;
- величина рН не менее 6,8;
- щелочность более (1+ /28) мг-экв/л, где - концентрация двухвалентного железа в мг/л;
- содержание сероводорода не более 2 мг/л;
- перманганатная окисляемость не более (0,15 + 5 мг/л О 2).
Если одно из этих условий не выдерживается, нужна предварительная аэрация воды в аэраторах с добавлением в нее необходимых реагентов (хлор, гипохлорит натрия, перманганат калия и др.)
FeSO 4 + Ca(OH) 2 = Fe(OH) 2 + CaSO 4 (3)
После известкования требуется отстаивание и фильтрация воды.
Упрощенную аэрацию можно реализовать путем излива воды в карман или в центральный канал открытых фильтров с высоты над уровнем воды 0,5-0,6 м.
При использовании напорных фильтров воздух вводят непосредственно в подающий трубопровод с нормой расхода 2 л на 1 г железа Fe 2+ . Если в исходной воде более 40 мг/л свободной углекислоты и более 0,5 мг/л сероводорода, то воздух в трубопровод не вводят. В этом случае перед напорным фильтром необходимо установить промежуточную емкость со свободным изливом воды и повысительный насос.
СНиП определяют расчетную скорость фильтрования при обезжелезивании воды упрощенной аэрацией с помощью нижеследующей таблицы.
Таблица 1
Используя характеристики конкретного наполнителя фильтра и руководствуясь параметрами табл. 1, можно выполнить расчет фильтровальной станции. СНиП требует, чтобы продолжительность работы фильтров между промывками составляла при нормальном режиме не менее 8-12 часов и не менее 6 часов при форсированном режиме или при полной автоматизации промывки фильтра.
Общую поверхность фильтрования можно определить по формуле:
F = Q / (T ст v н - n пр q пр - n пр t пр v н), (1)
где Q - полезная производительность фильтровальной станции за 1 сутки, м 3 ; T ст - продолжительность работы станции в течение суток, ч; v н - расчетная скорость фильтрования при нормальном режиме, м/ч, принимаемая по табл. 1, с учетом соотношения (3); n пр - число промывок одного фильтра в сутки при нормальном режиме эксплуатации; q пр - удельный расход воды на одну промывку одного фильтра, м 3 /м 2 (определяется из паспортных данных фильтра и эксплуатационных характеристик наполнителя); t пр - время простоя фильтра в связи с промывкой, ч (определяется из паспортных данных фильтра и рабочих характеристик наполнителя).
Количество фильтров в составе фильтровальной станции производительностью более 1600 м 3 /сутки должно быть не менее четырех. При производительности более 8-10 тыс. м 3 /сутки количество фильтров N следует определять с округлением до ближайших целых чисел (четных или нечетных в зависимости от компоновки фильтров) по формуле:
N = (F) 0,5 / 2 (2)
При этом должно быть выдержано соотношение:
V ф = V н N / (N - N 1) (3)
где N 1 - число фильтров, находящихся в ремонте; V ф - скорость фильтрования при форсированном режиме.
Аэрация на специальных устройствах
Аэрация на специальных устройствах используется, когда необходимо удалить из воды железо при концентрации его в воде выше 10 мг/л и увеличить величину рН выше 6,8.
Для осуществления аэрации используют вентиляторные градирни (дегазаторы), либо контактные градирни с естественной вентиляцией. На рис. 1 представлена схема установки для обезжелезивания воды аэрацией. Исходная вода через патрубок 1подается в верхнюю часть вентиляторной градирни, заполненной керамической насадкой 4 (кольца Рашига размером 25х25х4 мм) или деревянной хордовой насадкой из брусков. Навстречу потоку воды с помощью вентилятора 5 направляют воздух. В процессе аэрации выделяется углекислота (диоксид углерода), а вода обогащается кислородом. Из градирни вода стекает в контактную емкость 7, откуда насосом подается в напорный фильтр. В объеме наполнителя фильтра завершается образование хлопьев гидроксида трехвалентного железа и их задержание.
Рис. 1. Схема установки обезжелезивания воды аэрацией.
1 - патрубок для подачи исходной воды в вентиляторную градирню; 2 - водосливные трубки; 3 - воздушные трубки; 4 - насадка; 5 - вентилятор; 6 - патрубок для отвода обработанной воды; 7 - контактная емкость с гидравлическим затвором; 8 - патрубок для выхода газов из градирни.
Площадь поперечного сечения дегазатора вычисляется исходя из плотности орошения (П ор):
- керамическая насадка - 60 м 3 /ч на 1 м 2 площади дегазатора,
- деревянная хордовая насадка - 40 м 3 /ч на 1 м 2 площади.
Вентилятор дегазатора должен обеспечивать подачу не менее 15 м 3 воздуха на каждый куб. метр обрабатываемой воды. Определение напора, развиваемого вентилятором, следует производить с учетом сопротивления насадки. На каждый метр высоты слоя керамической насадки «теряется» 30 мм вод. ст., а для деревянной хордовой - 10 мм вод. ст.
Время пребывания воды в контактной емкости t конт (после дегазатора) составляет 30-45 минут.
Высота слоя насадки, необходимая для снижения содержания диоксида углерода в воде, определяется с помощью табл. 2. Содержание диоксида углерода в воде, подаваемой в градирню (дегазатор) зависит от концентрации растворенного (равновесного) свободного диоксида углерода [СО 2 ] св, мг/л и карбонатной жесткости исходной воды, разрушаемой при водоподготовке, мг-экв/л :
[СО 2 ] = ([СО 2 ] св + 44 Ж к) (4)
Таблица 2
Блок аэрационного окисления входит в состав установки «Деферрит», разработанной НИИ коммунального водоснабжения и очистки воды и выпускаемой предприятием «Водкоммунтех». Производительность установки по очищенной воде от 50 до 20000 м 3 /сут.
ПРИМЕР 1. Выполнить расчет установки обезжелезивания производительностью:
- суточная, Q сут - 12000 м 3 ,
- часовая, Q час - 500 м 3 .
Концентрация свободного диоксида углерода - 35 мг/л, карбонатная жесткость - 4,5 мг-экв/л.
Для аэрации использовать дегазатор с вентилятором. Насадка дегазатора - кольца Рашига.
1. Требуемая площадь дегазатора F дег, м 2 , определяем по формуле:
F дег = Q час / П ор
Плотность орошения дегазатора, заполненного кольцами Рашига, составляет 60 м 3 /ч.
Тогда: F дег = 500/60 = 8,33 м 2 .
2. Диаметр дегазатора определим по формуле:
D = (4 F дег / 3,14) 0,5 = (4*8,33 / 3,14) 0,5 = 3,26 м.
3. С помощью выражения (4) определим содержание диоксида углерода в исходной воде: [СО 2 ] = (35 + 44*4,5) = 233 мг/л.
Высота слоя насадки из колец Рашига Н р принимается в соответствии с таблицей 2 равной 5,5 м.
4. Производительность вентилятора дегазатора равна:
Q вент = 15 * Q час = 15*500 = 7500 м 3 /ч.
5. Напор, который необходимо развивать вентилятору, равен:
Н вент = 30 * Н р = 30*5,5 = 165 м.
6. Объем контактной емкости:
V конт = Q час t конт /60 = 500*40/60 = 333,33 м 3 .
Если принять высоту слоя воды в контактной емкости в виде цилиндрического резервуара 8 м, то ее диаметр будет равен 7,3 м.
Коагуляция и осветление, известкование
Из поверхностных вод, как правило, необходимо удалить взвеси и коллоидно-дисперсные вещества, включающие соединения железа. Освобождение воды от взвеси и коллоидных веществ возможно осуществить только путем ввода специальных реагентов-коагулянтов. Данный метод обработки воды называют коагуляцией. Коагулянт образует в воде хлопья, которые адсорбируют на своей поверхности коллоиды и выделяются в виде осадка.
Рабочий режим и оборудование для осветления и коагуляции исходной воды выбирают исходя из характера и уровня содержания загрязнений. При этом если необходимо одновременно повысить щелочность воды и снизить ее солесодержание, рассматриваемые процессы совмещают с известкованием.
Процесс коагуляции достаточно сложен и нет строгих стехиометрических соотношений между дозой коагулянта и количеством растворенных коллоидных веществ в исходной воде. Поэтому дозу определяют методом пробного коагулирования.
В качестве коагулянтов применяют:
- сульфат алюминия (глинозем) Al 2 (SO4) 3 * 18 H 2 O при рН исходной воды 6,5-7,5;
- сульфат железа (железный купорос) FeSO 4 * 7 H 2 O при рН воды 4-10;
- хлорное железо FeCl 3 * 6 H 2 O для воды с рН 4-10.
Для интенсификации процесса коагуляции в воду дополнительно вводят флокулянты (наиболее распространен полиакриламид). Флокулянты способствуют укрупнению осадка и ускоряют процесс слипания осаждаемых коллоидных и взвешенных частиц .
При достаточном содержании в воде карбонатной жесткости (выше 1 мг-экв/л) коагулянты вначале образуют неустойчивые бикарбонаты (реакции 4), которые разлагаются с образованием хлопьев гидроксидов (реакции 5):
Al 2 (SO 4) 3 + 3 Са(HCO 3) 2 = 2 Al(HCO 3) 3 + 3 CaSO 4 (4)
FeSO 4 + Ca(HCO 3) 2 = Fe(HCO 3) 2 + CaSO 4
2 Al(HCO 3) 3 = 2 Al (OH) 3 ↓ + 6 CO 2 (5)
4 Fe(HCO 3) 2 + O 2 + 2 H 2 O = 4 Fe(OH) 3 ↓ + 8 CO 2
По реакции 5 видно, что для образования хлопьев гидроксида железа необходимо наличие в воде растворенного кислорода.
Если карбонатная жесткость исходной воды невелика, то ее подщелачивают раствором гидроксида натрия или «известковым молоком» (раствор Ca(OH) 2):
4 FeSO 4 + 4 Ca(OH) 2 + 2 H 2 O + O 2 = 4 Fe(OH) 3 ↓ + 4 CaSO 4 (6)
Осветление и обесцвечивание мутных вод с повышенной жесткостью предпочтительнее осуществлять коагулянтами при высоких значениях рН, а цветных мягких вод - при пониженных рН.
При реализации процесса коагуляции температуру воды поддерживают в пределах 20-25 о С, а при осуществлении коагуляции с известкованием воду подогревают до 30-40 о С.
Дозу коагулянта сульфата алюминия обычно принимают в пределах 0,5-1,2 мг-экв/л. Для воды с умеренным (до 100 мг/л) содержанием взвеси и с небольшой окисляемостью дозу понижают, а для вод с содержанием железа и с высокой окисляемостью (15 мг/л О 2 и выше) ее повышают до 1,5 мг-экв/л. Для цветных вод дозу можно ориентировочно определить по формуле :
Д к = 4 (Ц) 0,5 , (5)
где Д к - доза коагулянта, мг/л; Ц - цветность воды, градусы.
Дозировка флокулянта полиакриламида в виде 0,1 %-ого раствора составляет 0,1-1,0 мг на каждый литр обрабатываемой воды (в пересчете на 100%-ный продукт). Флокулянт добавляют спустя 1-3 минуты после дозирования коагулянта с целью завершения формирования микрохлопьев и адсорбции загрязнений.
При необходимости подщелачивания воды дозу щелочи можно определить из выражения:
Д щ = Э щ (Д к /Э к - Щ + 1)*100/С, (6)
где Д щ - доза щелочи, мг/л;
Э щ - эквивалентная масса активной части пощелачивающего реагента, равная для извести 28 (в пересчете на СаО) и 53 для соды (в пересчете на Na 2 CO 3), мг/мг-экв;
Э к - эквивалент безводного коагулянта, равный 57,02 мг/мг-экв для Al 2 (SO 4) 3 ; 75,16 - FeSO 4 ; 54,07 - FeCl 3 ;
Щ - общая щелочность исходной воды + 1 (резервная щелочность), мг-экв/л;
С - концентрация активного вещества в реагенте для подщелачивания, %.
Если величина Д щ при расчете по выражению (6) отрицательна, то подщелачивания не требуется.
Когда в исходной воде содержание взвешенных веществ менее 100 мг/л, коагуляцию осуществляют непосредственно на осветлительных фильтрах с дозировкой коагулянта в подающий трубопровод. Расстояние от точки ввода коагулянта до фильтра должно составлять ≥ 50 диаметров трубопровода (50 Dу).
При концентрации взвеси более 100 мг/л в обрабатываемую воду помимо коагулянта вводят полиакриламид с соответствующим временным разрывом, а процесс ведут в осветлителе.
Дозирующие насосы подбирают исходя из максимальной дозы коагулянта. Cуточный расход коагулянта (в пересчете на безводный 100 %-ный продукт, кг) определяют по формуле:
P к = 24*Q час *Э к *Д к /1000, (7)
где Q час - производительность установки по воде, м 3 /ч;
Э к - эквивалент безводного коагулянта, равный 57,02 для Al 2 (SO 4) 3 ; 75,16 - FeSO 4 ; 54,07 - FeCl 3 ;
Д к - максимально требуемая доза коагулянта, мг-экв/л.
Расход раствора коагулянта находят при помощи следующего соотношения:
V к = 100 *Р к / (С к *ρ к), (8)
где V к - суточный объем раствора коагулянта, м 3 /сутки;
С к - концентрация коагулянта в дозируемом растворе, обычно равна 5-10 %;
ρ к - плотность раствора коагулянта, кг/м 3 .
Введение реагентов-окислителей
Использование реагентов-окислителей, в первую очередь хлора, с целью обеззараживания, а также удаления железа, используется в России с начала ХХ века. Кульский Л.А. указывал, что хлорирование почти во всех случаях освобождает воду от содержащегося в ней железа. После обработки разных вод этим методом содержание железа во всех случаях остается меньше 0,1 мг/л, причем этот метод эффективен, когда другие приемы не работают. Под действием хлора происходит разрушение гуматов и других органических соединений железа и переход их в форму неорганических солей трехвалентного железа, которые легко гидролизуются. В результате гидролиза выпадает осадок гидроксида железа, либо продуктов неполного гидролиза - основных солей железа различного состава. Эти процессы можно условно описать следующим брутто-уравнением:
4 Fe(HCO 3) 2 + 2 Cl 2 + 4 H 2 O = 4 Fe(OH) 3 ↓ + 8 CO 2 + 4 HCl (7)
Как видно из уравнения (7) вода подкисляется. По стехиометрии (по уравнению реакции) на окисление 1 мг двухвалентного железа расходуется 0,64 мг хлора, при этом щелочность снижается на 0,018 мг-экв/л.
Хлор также окисляет двухвалентный марганец, разрушает органические вещества и сероводород.
Доза хлора в зависимости от содержания железа может составлять 5-20 г на 1 куб. метр воды при контакте, по крайней мере, 30 минут (не только для окисления железа, но и для надежного обеззараживания). При этом гигиенические требования допускают содержание свободного хлора в питьевой воде до 0,5 мг/л, а связанного до 1,2 мг/л.
СНиП определяет расчетную дозу хлора (в пересчете на 100 %, мг/л) для целей обезжелезивания следующим выражением:
Д х = 0,7 * , (9)
где - концентрация двухвалентного железа в мг/л.
Дозу активного хлора для целей обеззараживания воды устанавливают на основе данных технологических изысканий. Если они отсутствуют, то для предварительных расчетов следует принимать 2-3 мг/л для поверхностной фильтрованной воды, 0,7-1,0 мг/л для вод из подземных источников.
Обработку воды хлором осуществляют с помощью хлораторов, в которых газообразный (испаренный) хлор абсорбируют водой. Хлорную воду из хлоратора подают к месту потребления. Хотя данный метод обработки воды и является наиболее распространенным, тем не менее, он обладает целым рядом недостатков. В первую очередь это связано со сложной транспортировкой и хранением больших объемов жидкого высокотоксичного хлора. На станциях водоподготовки необходимо наличие экологически опасных стадий хлорного хозяйства, таких как разгрузка емкостей с жидким хлором, его испарения для перевода в рабочую форму. Создание рабочих запасов хлора на складах представляет опасность не только для рабочего персонала станции, но и для населения .
Как альтернативу хлорированию в последние годы все шире используют обработку воды раствором гипохлоритом натрия (NaClO), причем этот метод находит применение, как на больших станциях водоподготовки, так и на небольших объектах, в том числе и в частных домах.
Водные растворы гипохлорита натрия получают химическим:
Cl 2 + 2 NaOH = NaClO + NaCl + H 2 O, (8)
или электрохимическим методом:
NaCl + H 2 O = NaClO + H 2 , (9).
В соответствии с раствор гипохлорита натрия, получаемый по химическому методу, выпускается в виде трех марок. Ниже приведены показатели по составу продуктов.
Обеззараживание воды и окисление примесей с использованием гипохлорита натрия, производимого электрохимически, впервые было применено в США в конце 30-х годов прошлого столетия. Дальнейшее развитие электрохимии, разработка конструкций новой электрохимической аппаратуры с использованием современных стойких электродных материалов, позволило создать установки, способные конкурировать с другими методами обеззараживания воды .
В качестве примера можно указать электрохимические установки серии «Санатор ® », разработанные и выпускаемые предприятием «Экосервис Технохим». Установка «Санатор ® » готовит гипохлорит натрия из поваренной соли непосредственно на месте потребления. Кроме того, они снабжены устройством пропорционального дозирования раствора гипохлорита в подающий трубопровод перед фильтрами. На рис. 2 показана схема подачи гипохлорита в магистральный трубопровод, на рис. 3 принципиальная схема подключения установки.

Рис. 2. Схема подключения трубной сборки.
1 - патрубок подачи исходной воды; 2 - патрубок вывода обработанной воды; 3 - патрубок с обратным клапаном для подачи раствора гипохлорита натрия; 4 - водосчетчик; 5 - гибкий шланг с накидной гайкой; V1-V4 - шаровые краны.

Рис.3. Принципиальная схема подключения Санатора.
1 - сетевой кабель; 2 - микроконтроллер; 3 - кабель импульсного вывода; 4 - кабель нагрузки; 5 - распределительная колодка (розетки); 6 - кабель подключения блока питания; 7 - блок питания Санатора; 8 - кабель подключения дозирующего насоса; 9 - кабель подключения электродной кассеты; 10 - бак Санатора; 11 - дозирующий насос; 12 - водосчетчик; V1-V4 - шаровые краны.
Гипохлорит натрия обладает рядом свойств, ценных в техническом отношении. Его водные растворы не имеют взвесей и поэтому не нуждаются в отстаивании, например, в противоположность хлорной извести. Применение гипохлорита натрия для обработки воды не вызывает увеличения ее жесткости, так как он не содержит солей кальция и магния как хлорная известь или гипохлорит кальция. Бактерицидный эффект раствора NaClO, полученного электролизом, выше, чем у других дезинфектантов, действующим началом которых является активный хлор. Кроме того, он обладает еще большим окислительным действием, чем растворы, приготовленные химическим методом из-за более высокого содержания хлорноватистой кислоты (HClO).
Окисление двухвалентного железа происходит в соответствии со следующим уравнением:
2 Fe(HCO 3) 2 + NaClO + H 2 O = 2 Fe(OH) 3 ↓ + 4 CO 2 + NaCl (10)
Расчет установки для обработки воды гипохлоритом натрия в первую очередь требует определить расход активного хлора на процессы окисления, обеззараживания и разрушение сероводорода.
Требуемый расход активного хлора на обработку воду АХ (в пересчете на 100% хлор, г/ч) определяется следующим выражением:
AX = Q час * {Д х + * K Fe ] + * K Mn + * K CB }, (9)
где Q час - объемный расход воды (максимальный), м 3 /ч;
Д х - доза активного хлора для обеззараживания воды, мг/л;
Содержание двухвалентного железа в исходной воде, мг/л;
K Fe - расход активного хлора для окисления железа (0,67 мг активного хлора на 1 мг двухвалентного железа);
K Mn - расход активного хлора для окисления двухвалентного марганца (1,3 мг активного хлора на 1мг марганца);
K CB - расход активного хлора для разрушения сероводорода (2,1 мг активного хлора на 1 мг сероводорода).
Как следует из уравнения реакции (10) в процессе окисления железа гипохлоритом натрия не происходит подкисления воды, а это очень важно для процесса фильтрации. Кроме того, раствор гипохлорита натрия как товарный, так и электрохимический, щелочной, что благоприятно для фильтрования.
ПРИМЕР 2. Выполнить расчет установки для обработки воды товарным раствором гипохлорита натрия марки «Б» с содержанием активного хлора 170 г/л. Раствор перед введением гипохлорита разбавить в 17 раз (К р -коэффициент разбавления) до концентрации С р =10 г/л (рабочий раствор).
Часовая производительность установки по воде, Q час - 5,5 м 3 ,
суточный расход воды, Q сут - 88 м 3 , т.е. установка работает t=16 часов в сутки.
Состав исходной воды:
- двухвалентное железо 8 мг/л,
- двухвалентный марганец 0,5 мг/л,
- сероводород 0,4 мг/л,
- величина рН = 6,9.
Пробная обработка воды показала необходимость введения 3,5 мг/л активного хлора для целей обеззараживания.
1. Требуемый расход активного хлора (в пересчете на 100%) определим по выражению (9):
АХ = 5,5 * (3,5 + 8*0,67 + 0,5*1,3 + 0,4*2,1) = 56,9 г/ч.
2. Скорость подачи рабочего раствора гипохлорита натрия (необходима для подбора дозирующего насоса по производительности):
П гн = АХ / С р = 56,9 / 10 ≈ 6 л/ч.
3. Суточный расход рабочего раствора гипохлорита (необходим для подбора бака для хранения и дозирования рабочего раствора):
П гн * t = 6*16 = 96 л.
4. Суточный расход товарного раствора гипохлорита натрия марки «Б» (необходим для определения затрат на реагент):
Р гн = П гн * t / К р = 6 * 16 / 17 = 5,6 л.
Используется также метод окисления двухвалентного железа путем введения в исходную воду перед фильтрами раствора перманганата калия KMnO 4 . Последний может также вводиться в сочетании с гипохлоритом натрия с целью обработки сложных вод и экономии достаточно дорогостоящего окислителя - перманганата калия.
При обработке воды перманганатом реакция окисления железа с последующим гидролизом протекает по уравнению (упрощенная запись):
4 Fe(HCO 3) 2 + MnO 4 - + 2 H 2 O = 4 Fe(OH) 3 ↓ + MnO 2 ↓ + 8 CO 2 (11)
По уравнению (11) на окисление 1 мг Fe 2+ тратится 0,71 мг перманганата калия, а щелочность воды снижается на 0,036 мг-экв/л. СНиП определяет расчетную дозу перманганата калия (в пересчете на 100 %, мг/л) для окисления железа и марганца при помощи следующего выражения:
Д пк = + 2* , (10)
где - концентрация двухвалентного железа в исходной воде, мг/л;
Концентрация двухвалентного марганца, мг/л.
Для приготовления рабочих растворов перманганата калия следует руководствоваться данными по растворимости перманганата в воде:
- при температуре 20 0 С 6,34 г KMnO 4 на100 г воды;
- при 60 0 С 22,2 г KMnO 4 на100 г воды.
При совместном введении в обрабатываемую воду перманганата калия и гипохлорита натрия дозы этих реагентов (в пересчете на 100% продукт, мг/л) можно определить из уравнений:
Д пк = 0,2* + 2* , (11)
Д гн = 0,7*.
При сравнении уравнений (10) и (11) следует, что совместный ввод реагентов позволяет сэкономить до 80% перманганата калия. Введение перманганата перед подачей гипохлорита натрия разрушает органические вещества, вступающие в реакцию с хлором с образованием продуктов с резким запахом, например фенолы. Если ввод реагентов осуществить в другой последовательности, то перманганат калия будет разрушать образованные хлорпродукты.
Одним из перспективных методов окисления железа является озонирование. Озон О 3 является одним из самых сильных окислителей, уничтожающих бактерии, споры и вирусы. По сравнению с хлором применение озона оказывается более эффективным для окисления детергентов, гербицидов, пестицидов, фенолов и для окисления других трудно окисляемых химических соединений. Одновременно с обеззараживанием идут процессы окисления двухвалентных железа и марганца, обесцвечивание воды, а также ее дезодорация и улучшение органолептических свойств.
Озон получают из воздуха в специальных аппаратах - озонаторах. В озонаторе при прохождении электрического тока через разрядное пространство с воздухом происходит разряд коронного типа, в результате чего из кислорода воздуха образуется озон.
По стехиометрии можно определить дозу озона на окисление двухвалентного железа по следующему выражению:
Д оз = 0,14 * , мг/л (12)
где - концентрация двухвалентного железа в исходной воде, мг/л.
Доза озона зависит от цели, для которой используют озонирование воды. Для обеззараживания фильтрованной воды доза озона составляет 1-3 мг/л, для обработки подземных вод - 0,75-1 мг/л. При введении озона для окисления железа, обесцвечивания воды с одновременным обеззараживанием доза может доходить до 4 мг/л. Озоно-воздушную смесь из озонатора вводят в воду с помощью эжекторов или через сеть пористых труб, уложенных в камерах смешения.
Концентрация остаточного озона после камер смешения должна быть 0,1-0,3 мг/л. Продолжительность контакта озона с водой зависит от состава воды, концентрации озона в озоно-воздушной смеси, конструкции смесителя, температуры и в среднем составляет 5-20 минут, часто 5-12 минут.
Наша промышленность производит низкочастотные озонаторы, работающая на токе промышленной частоты, а также высокочастотные (0,4-10 кГц), которые более компактные и менее металлоемкие. Завод «Курганхиммаш» серийно выпускает озонаторы производительностью по озону от 0,25 до 10 кг/ч.
Необходимо отметить, что озон высокотоксичен и может поражать органы дыхания. Предельно-допустимая концентрация озона в воздухе рабочей зоны (ПДК р.з.) составляет 0,1 мг/м 3 . Для сравнения можно указать, что для хлора эта величина в 10 раз менее жесткая и равна 1 мг/м 3 .
Хотя метод озонирования имеет блестящие перспективы, однако оборудование пока достаточно дорогостоящее, а процесс характеризуется сравнительно большим расходом электроэнергии.
Удаление воды из железа методом ионного обмена (катионирование) допускается, когда одновременно с обезжелезиванием требуется умягчение воды. Однако в этом случае, возможно, только извлечь железо в растворенной двухвалентной форме, а ресурс работы ионообменного материала будет значительно снижен. При этом в очищаемой воде должен отсутствовать кислород.
Известно, что человек не может обходиться без воды более чем пару дней, ведь все обменные процессы в организме сопровождаются ее участием. Поэтому важно задуматься, какую воду мы употребляем. В ней может быть повышенное содержание хлора, солей магния и кальция, марганца и железа. Каждый вид примесей удаляется разными способами. Рассмотрим, как совершается очистка воды от железа.
Виды железа
Для начала нужно определить, какое железо содержится в воде.
Двухвалентное. Железо этого типа хорошо растворяется в воде, поэтому невооруженным глазом его заметить нельзя. Вода имеет обманчивую прозрачность. Однако, если она некоторое время контактирует с воздухом, то происходит окисление железа и переход его в трехвалентную форму. Тогда вода приобретает рыжий оттенок.
Трехвалентное. Это окисленное железо, в жидкости оно встречается в коллоидной форме (мелкие частички рыжего цвета). Зачастую в воде, содержащей трехвалентное железо, присутствует также и двухвалентный тип. Кроме того, оседание рыжих частиц может сопровождаться образованием железобактерий, а впоследствии и их увеличением.
Бактериальное. Представляет собой живые и мертвые бактерии, а также их продукты жизнедеятельности и оболочки. В большинстве случаев сопутствует коллоидному железу. Внешне это слизистые мягкие отложения, которые могут быть как вредны, так и нет. Наличие железобактерий в трубопроводе приводит к язвенной коррозии железа.

Способы очистки воды от железа
Растворенное двухвалентное железо можно удалить традиционными методами, предназначенными для устранения растворенных неорганических ионов. Это ионный обмен, суть которого заключается в замещении в процессе реакции специальных смол на ион натрия, и обратный осмос, его принцип состоит в использовании мембран, задерживающих растворенное железо.
Еще одним методом очистки воды от железа двухвалентного типа является химический способ. Принцип его заключается в каталитическом окислении, в процессе которого химический элемент переходит из растворенного состояния в нерастворенное. После этого образованное трехвалентное железо оседает на фильтре. Системы такого вида носят название фильтры-обезжелезиватели.
Воду с повышенным содержанием рыжих мелкодисперсных частиц очищают методом ультрафильтрации.
При устранении бактериального типа железа необходимо применить хлор или хелатные агенты.
Следует помнить, что методы очистки воды от железа имеют свои недостатки и преимущества.
Обратный осмос
Очистка воды от железа с помощью обратного осмоса состоит в продавливании ее через очень тонкую мембрану. Она не дает пройти даже мельчайшим примесям. Подобный результат очищения не способен гарантировать ни один фильтр очистки воды от железа, работающий по другому методу. Именно поэтому система обратного осмоса представляется действительно уникальной.
Для хорошей работы такого фильтра нужно обеспечить полное отсутствие кислорода, иначе произойдет окисление, и двухвалентное железо превратится в дисперсное, которое впоследствии будет накапливаться на мембране. Это не является проблемой, потому что системы обратного осмоса обладают хорошей герметичностью.
Также таким методом можно удалить и трехвалентное железо, в том случае, если оно присутствует в воде в небольшом количестве. Технология обратного осмоса дает возможность избавиться и от марганца — известного спутника железа.

Ионный способ
Такой метод применяется довольно давно, однако раньше для очистки воды использовались цеолиты и сульфоуголь. В настоящее время для того, чтобы удалить железо, употребляются специальные С их помощью эффективность этого способа стала гораздо выше. Кроме двухвалентного железа, используемые катиониты устраняют ионы кальция и магния. Также ионный метод очистки способен удалить марганец, который так часто присутствует в воде.
Однако стоит знать, что этот метод не подойдет в том случае, если находится на нормальном уровне. Ведь система очистки воды от железа путем ионного обмена предполагает понижение этого показателя. Способ применяется исключительно в ограниченных диапазонах рН. Кроме того, негативно влияют присутствующие в воде, они могут привести к возникновению бактерий на фильтре.
Самая сложная задача здесь — это правильно подобрать оптимальную комбинацию смол. Тогда от железа не останется и следа, ведь очистка воды ионным способом в настоящее время является одним из самых действенных.

Химический метод очистки воды
Часто для очистки железа в растворенном виде используется окислительный способ. Он подразумевает применение таких окислителей, как перманганат калия, хлор, кислород, озон. С их помощью ускоряется процесс превращения растворенного железа в трехвалентное, а добавление в воду коагулянтов (химических веществ) способствует осаждению частиц. Такой принцип чаще применяется на крупных системах очистки.
В бытовых условиях используется каталитический метод. Очистка воды от железа сопровождается окислительной реакцией, что происходит на поверхности фильтра, свойства которого значительно ускоряют процесс окисления. Такие системы изготавливаются на основе диоксида марганца, способного удалить железо. Для улучшения результата в воду можно добавлять марганцовку.
Особенности фильтров-обезжелезивателей
Если выбор пал на систему очистки воды, основанную на окислении железа, то следует учитывать ряд параметров, это:
- температура воды;
- содержание кислорода в растворенном виде;
- щелочность.
Эти факторы могут повлиять на качество работы. Перед эксплуатацией следует ознакомиться с рекомендациями производителя и соблюдать их при дальнейшем использовании. Особенно нужно обратить внимание на скорость прямого потока воды и при обратной промывке, а также на допустимое содержание железа.
К распространенным причинам плохой эффективности фильтров-обезжелезивателей относится неполное окисление железа, подача на очистку большого объема воды, невысокая скорость потока воды во время обратной промывки. Коэффициент содержания железа не должен превышать отметку в 15 мг/л. Фильтры-обезжелезиватели отличаются большим удельным весом, что является их существенным недостатком.
Удаление трехвалентного железа
При большом содержании коллоидного железа наиболее эффективными считаются системы ультрафильтрации. Принцип действия таких систем заключается в прохождении частиц через мембранную сетку. В результате этого процесса совершается очистка воды от железа.
Для ультрафильтрации применяются специальные мембраны, размер пор которых составляет 0,05 мк. Эффективность данного метода обезжелезивания воды обусловлена тем, что система способна работать в разных режимах. Особенно необходимо отметить обратную промывку мембран, которая позволяет исключить возникновение засоров.
Для достижения большей эффективности перед очисткой железо лучше перевести в окисленное состояние.
Биологический способ обезжелезивания
Биологический метод направлен на превращение растворенного железа в окисную форму с помощью железобактерий. Они не представляют опасности для человека, в отличие от их продуктов жизнедеятельности.
Железобактерии проявляют активность при уровне железа от 10 до 30 мг/л, однако могут развиваться и при содержании вредной примеси ниже этих показаний. Чтобы микроорганизмы нормально существовали, нужно поддерживать кислую среду на низком уровне, одновременно обеспечивая подачу кислорода из воздуха.
В завершение биологического способа обезжелезивания происходит удаление продуктов жизнедеятельности железобактерий с помощью адсорбции, затем вода обрабатывается бактерицидными лучами для того, чтобы окончательно очистить жидкость.
Безусловно, такой метод экологичен и эффективен, однако у него есть большой минус: низкая скорость процесса. Кроме того, чтобы производительность очистки была на должном уровне, необходимо иметь очистные емкости больших размеров.

Очистка питьевой воды
В домашних условиях очистка воды осуществляется при помощи следующих методов:
- Отстаивание. Это самый элементарный способ: воду оставляют на несколько часов, в течение которых примеси и осадки опускаются на дно. Однако эффективность такого метода невысока, после процедуры жидкость придется прокипятить.
- Заморозка. Воду следует налить в емкость и отправить в морозильную камеру. После того как основная часть превратится в лед, остаток необходимо слить: он содержит примеси. Размораживая воду, надо выбросить последние льдинки, в них также присутствуют
- Шунгит и кремний. Минералы необходимо положить на дно емкости, затем залить водой и оставить минимум два дня. По истечении времени ту воду, которая находится сверху, можно слить и употреблять, а "нижнюю" следует вылить, в ней будет присутствовать осадок. Шунгит и кремний служат хорошими очистителями жидкости от вредных примесей.
- Уголь. Этот лекарственный препарат позволит избавиться от осадка и механических примесей. Нужно завернуть уголь в вату и пропустить воду через полученный самодельный фильтр.

Зачем очищать воду от железа
Присутствие железа в воде, которая не прошла фильтрацию, портит ее запах и вкус. Кроме того, нерастворенные частицы примеси окрашивают жидкость в коричневый оттенок. Постоянное употребление воды с большим количеством железа может привести к возникновению различных заболеваний, касающихся в первую очередь почек и печени. Также оно негативно скажется на состоянии кожи, могут появиться аллергические реакции, а в системе водоотведения будет накапливаться осадок.
Помимо нанесения ущерба человеческому здоровью, находящееся в воде железо приведет к таким последствиям, как появление на сантехнике подтеков желтого цвета, зарастание трубопроводов и их коррозия, значительное снижение и поломка оборудования на предприятиях.
Оптимальное значение содержания железа в воде - 0,3-0,5 мг/л. При больших показателях будет образовываться ржавчина, а при меньших появится мутность.

Стоимость обезжелезивания воды
Если у вас из-под крана течет вода с неприятным запахом и вскусом, то справиться с этой проблемой поможет очистка воды от железа. Цена фильтров в зависимости от вида и способа действия имеет разную стоимость.
Наиболее распространенным считается фильтр-кувшин, принцип действия которого основывается на попадании воды в емкость через слой сорбента. Стоимость такого кувшина колеблется от 200 до 2500 рублей.
Фильтры, которые предполагают размещение под мойкой, имеют более высокую стоимость. Системы обратного осмоса встречаются на рынке по цене от 5000 рублей, а электрохимическая фильтрация обойдется примерно в 25000 рублей.
На стоимость товара влияют наличие накопительной емкости, ее объем, а также степени очистки.
Не стоит забывать, что монтаж установки очистки воды от железа лучше предоставить специалистам, на услуги которых тоже придется потратиться.
Помощь он-лайн только по предварительной записи
Необходимая степень обезжелезивания воды определятся конечными целями, для которых эта вода будет использоваться. И хотя на сегодняшний день не существует единого универсального метода комплексного удаления всех существующих форм железа из воды, используя ту или иную схему очистки, можно добиться желаемого результата в каждом конкретном случае.
Окислительное обезжелезивание
Традиционные методы обезжелезивания воды основываются на окислении двухвалентного железа кислородом воздуха (аэрация) и сильными окислителями (хлор, перманганат калия, перекись водорода, озон) до трехвалентного состояния, с образованием нерастворимого гидроксида железа (III), который впоследствии удаляется отстаиванием, отстаиванием с добавлением коагулянтов и флоккулянтов (А-Т 9.303) и (или) фильтрацией.
Аэрация
Окисление железа аэрацией может проводиться: фонтанированием (так называемые брызгальные установки), душированием, с помощью инжектора, эжектора или компрессора, введением воздуха в трубу под напором, барботацией.
Во многих случаях вода, прошедшая обезжелезивание аэрацией с последующим остаиванием и фильтрацией, уже оказывается пригодной к употреблению в качестве питьевой. По такой упрощенной схеме обезжелезивание эффективно, когда исходная концентрация железа не превышает 10 мг/мл (при содержании двухвалентного железа не менее 70% от общего), концентрация H2S не более 2,5 мг/л. Окислительно-восстановительный потенциал (редокс- потенциал) воды после аэрации не должен быть ниже 100 мВ, а индекс стабильности (индекс Ланжелье) не менее 0,05.
Выбор способа упрощенной аэрации зависит от параметров исходной воды. Так, если концентрация сероводорода выше 0,5 мг/л, а свободной углекислоты – более 40 мг/л, введения воздуха в трубопровод под напором не требуется – достаточно предусмотреть открытую емкость со свободным изливом в нее воды. Аналогичного эффекта можно достичь с помощью фонтанирования или душирования.
Окисление двухвалентного железа с добавлением сильных окислителей
Добавление в воду сильных окислителей значительно интенсифицирует процесс окисления двухвалентного железа. Наиболее широко применяется хлорирование, позволяющее также решить проблему дезинфекции воды, а наиболее эффективным оказывается озонирование (рис. 2). Хотя бы еще потому, что, за исключением озона, другие окислители оказываются малоэффективными по отношению к органическому железу. Однако озонирование является и наиболее дорогостоящим методом, требующим больших затрат электроэнергии. Кроме того, практически всегда обезжелезивание происходит одновременно с удалением из воды марганца, который окисляется значительно труднее, чем железо, и при более высоких значениях pH.
Осаждение коллоидного железа традиционным промышленным способом
В обычных условиях процесс осаждения коллоидных частиц гидроксида трехвалентного железа (размер частиц 1–3 мкм) при отстаивании происходит медленно. Укрупнения частиц и, следовательно, ускорения осаждения достигают добавлением коагулянтов. Этого же требует использование на очистительных сооружениях песчаных или антрацитовых фильтров, не способных задерживать мелкие частицы. Так же плохо эти фильтры задерживают органическое железо.
Медленное осаждение коллоидных частиц гидроксида железа (III) вкупе с малой эффективностью применения окислителей и аэрации по отношению к органическому железу, а также ограничение по верхней концентрации железа в исходной воде затрудняет применение традиционной промышленной схемы обезжелезивания в сравнительно небольших автономных системах, работающих с высокой производительностью. В таких схемах применяются иные установки, обезжелезивание в которых проводится по принципам каталитического окисления с последующей фильтрацией и ионообмена.
Каталитическое окисление с фильтрацией
Это наиболее применяемый сегодня метод для промышленного водоснабжения отдельных не самых крупных предприятий, отдельных коттеджей. Установки для каталитического окисления и фильтрации компактны и отличаются достаточно высокой производительностью (0,5–20,0 м3/ч и более в зависимости от сорбента, исходных качеств воды, геометрических характеристик резервуара – баллона из стекловолокна или нержавеющей стали). Реакция окисления железа происходит внутри резервуара установки на гранулах засыпки – специальной фильтрующей среды с каталитическими свойствами. В первую очередь каталитические и фильтрующие свойства этих материалов определяются их высокой пористостью, обеспечивающей среду для протекания реакции окисления и обусловливающей способность к абсорбции.
Широко применяется в качестве каталитической засыпки синтетический материал Birm, позволяющий эффективно и экономично удалять из воды соединения железа и марганца низких и средних концентраций. В установки с засыпкой из Birm подается предварительно аэрированная вода. Доля растворенного в ней кислорода должна быть не менее 15% доли железа (или железа и марганца). Высокая пористость материала и малая насыпная масса (0,7–0,8 г/см3) позволяют легко удалять осадки при обратной промывке. Щелочность в исходной воде должна быть в два раза больше, чем концентрация хлоридов и сульфатов. Недостатками материала Birm являются его высокая склонность к истиранию, из-за чего за год теряется до 10–15 % засыпки, и не самый широкий диапазон рабочих значений pH – 8,0–9,0. Его преимущество – невысокая стоимость.
Также довольно широко применяются каталитические засыпки на основе природных минералов, таких как доломит, цеолит, глауконит. Используется и синтетический цеолит.
На основе доломита, содержащего карбонаты кальция и магния, изготавливаются такие каталитические засыпные материалы, как Магнофилт и Дамфер, отличающиеся высокой пористостью, способствующей проявлению каталитических свойств, большим диапазоном рабочих температур, щелочной реакцией. Защелачивание среды ускоряет реакцию окисления двухвалентного железа растворенным в воде кислородом. При термической обработке карбонат магния, содержащийся в доломите, переходит в оксид MgO, при контакте с водой оксид гидролизуется и высвобождает в раствор гидроксильные ионы, которые связывают в свою очередь ионы водорода и способствуют ускорению реакции окисления двухвалентного железа. Эта особенность характерна для всех фильтрующих материалов с каталитическими свойствами, созданных на основе доломита. Зерна доломита, ко всему прочему, химически стойкие и очень прочные, поэтому практически не расходуются в процессе эксплуатации. Для Магнофилта существуют определенные ограничения: в исходной воде не должны присутствовать масла и сероводород, содержание органических веществ не должно превышать 4–5 мг/л, доля растворенного кислорода должна быть выше доли растворенного железа на 15%, pH = 6,8–8,5. При более высоких значениях pH образуются коллоидные формы трехвалентного железа, которые сложно фильтруются. Хлорирование снижает активность этого материала, поэтому дозировка хлора должна быть минимальной.
Дамфер обладает дополнительными достоинствами. Собственные каталитические свойства доломита в нем усиливаются за счет того, что на стадии термической обработки в состав материала вводится железо в каталитически активной форме, а также другие каталитические добавки: медь, серебро, марганец, фосфаты. Присутствие серебра в этом материале позволяет также подавлять рост железобактерий. По сравнению с материалом Birm скорость окисления железа на Дамфере выше в 250 раз. Кроме того, этот материал может работать при значениях pH ниже 6,0, очищает воду как от двухвалентного, так и от трехвалентного железа, не отравляется сероводородом и остаточным хлором. Слой гидроксида железа (III), образующийся при очистке на гранулах Дамфера, еще более усиливает его каталитические свойства. Во-первых, способствует каталитическому окислению железа, во-вторых, имея губчатую структуру, является дополнительным сорбентом, поглощая частицы песка, глины, тяжелые металлы и даже гуминовые кислоты.
Из глауконитового зеленого песка получают еще один широко распространенный материал для каталитической окислительной фильтрации – Glauconite Manganese Greensand. В процессе обработки глауконитового песка в состав Greensand вводятся высшие оксиды марганца, обеспечивающие дополнительную окислительную способность этого материала. К тому же кроме собственных каталитических и окислительных свойств Greensand связывает такие окисляющие агенты, как перманганат калия, хлор, растворенный кислород. Все это обеспечивает высокую скорость и полноту окислительных реакций. Greensand обладает высочайшей поглощающей способностью, эффективен при очистке воды с высокими концентрациями железа и марганца (суммарно до 10 мг/л) в широком диапазоне pH – 6,2–8,8. Системы с засыпкой из этого материала применяются для очистки воды из скважин любой глубины. Сероводород окисляется до нерастворимых сульфатов. Осадки фильтруются слоем Greensand и сопутствующими фильтрующими слоями. Сорбент не подвержен воздействию микроорганизмов, органических примесей, не требует дезинфекции. Регенерация среды проводится раствором перманганата калия с последующей промывкой исходной водой.
Существуют и другие материалы с каталитической и окислительной активностью применяемые в качестве засыпок для фильтров-обезжелезивателей, но на примере вышеуказанных можно получить представление об основных принципах удаления железа данным способом.
Ионообменный метод удаления железа
Для удаления железа этим методом применяются катиониты (рис. 3). Причем все шире на смену цеолиту и другим природным ионитам приходят синтетические ионообменные смолы; эффективность использования ионного обмена при этом значительно возрастает.
Любые катиониты способны удалять из воды не только растворенное двухвалентное железо, но также и другие двухвалентные металлы, в частности кальций и магний, для чего они в первую очередь и применяются. Теоретически методом ионного обмена можно удалять из воды очень высокие концентрации железа, при этом не потребуется стадии окисления растворенного двухвалентного железа с целью получения нерастворимого гидроксида. Однако на практике возможности применения данного метода значительно ограничены.
В первую очередь применение ионного обмена для обезжелезивания ограничивает присутствие трехвалентного железа, которое быстро «забивает» смолу и плохо оттуда вымывается. Поэтому любое присутствие в воде, проходящей через ионообменник, кислорода или других окислителей крайне нежелательно. Это же накладывает ограничение и на диапазон значений pH, в которых смола эффективна.
Во многих случаях использование ионообменных смол для обезжелезивания нецелесообразно, т. к., обладая более высоким сродством к катионитам, железо значительно снижает эффективность удаления на них ионов кальция и марганца, проведения общей деминерализации. Наличие в воде органических веществ, в том числе органического железа, приводит к быстрому зарастанию ионообменной смолы органической пленкой, служащей питательной средой для бактерий. Поэтому ионообменные катиониты применяются для обезжелезивания обычно лишь в тех случаях, когда требуется доочистка воды по этому параметру до самых низких концентраций и когда возможно одновременное удаление ионов жесткости.
Обезжелезивание мембранными методами
Микрофильтрационные мембраны пригодны для удаления коллоидных частиц гидроксида железа (III); ультрафильтрационные и нанофильтрационные мембраны способны удалять кроме этого коллоидное и бактериальное органическое железо, а метод обратного осмоса позволяет удалять до 98% растворенного в воде двухвалентного железа. Однако мембранные методы дорогостоящи и не предназначаются конкретно для обезжелезивания. Это происходит в процессе обеззараживания воды (микрофильтрационные мембраны), при глубокой ее очистке (ультрафильтрационные и нанофильтрационные) или обессоливании (обратный осмос). Кроме того, мембраны легко подвергаются зарастанию органической пленкой и забиванию поверхности нерастворимыми частицами, в том числе ржавчиной, а также поглощают растворенное двухвалентное железо и теряют способность эффективно задерживать другие вещества. Фирмы-производители обратноосмотических мембран гарантируют сохранение их технологических свойств в период эксплуатации при содержании общего железа в воде не более 0,1–0,3 мг/л, взвешенных примесей – не более 0,5–0,6 мг/л, перманганатной окисляемости – не более 5 мг О2/л и коллоидном индексе не более 2–4 единиц (параметры, учитывающие содержание органического железа).
Однако применение мембранных методов оправдано там, где просто необходима высокая степень очистки воды, в том числе и от железа, например, в медицинской или пищевой промышленности (рис. 4).
Биологическое обезжелезивание
Этот метод подразумевает использование железобактерий, окисляющих двухвалентное растворенное железо до трехвалентного, в целях очистки воды, с последующим удалением коллоидов и бактериальных пленок в отстойниках и на фильтрах. В некоторых случаях это оказывается единственным приемлемым способом снизить содержание железа в воде. Прежде всего когда концентрации железа в воде особенно велики, свыше 40 мг/л. Также применяют биологическое обезжелезивание, если в воде высоко содержание сероводорода и углекислоты. Такая вода с очень низким показателем pH не может быть очищена от избыточного железа методом упрощенной аэрации. Ее подвергают фильтрации через колонии бактерий на медленных фильтрах с песчано-гравийной загрузкой. Затем подвергают сорбционной очистке для задержания продуктов жизнедеятельности бактерий и ультрафиолетовому обеззараживанию.
Термины
Катиониты: – ионообменные сорбенты, способные к обмену катионов при контакте с растворами электролитов.
Иониты (ионообменники, ионообменные сорбенты): – вещества, способные к ионному обмену при контакте с растворами электролитов.
Ионообменные смолы: – ионообменные полимеры, синтетические органические иониты. Твердые, нерастворимые, ограниченно набухающие в растворах электролитов и органических растворителях сшитые полимеры, способные к электролитической диссоциации и обмену ионами при контакте с растворами электролитов.
Редокс-потенциал: – потенциал химических элементов в ряду электрохимических напряжений относительно потенциала нормального водородного электрода при 18 о С.
Подземные воды многих регионов земного шара часто характеризуются повышенным содержанием железа. Например, в Индокитае подземные воды с содержанием железа выше нормативов составляют около 60%. Железосодержащие воды широко распространены в Северной и Центральной Европе, в Сибири и на Дальнем Востоке, в Северной Америке, на Юге Африки.
Повышенное содержание железа в воде придает ей буроватую окраску, неприятный металлический привкус, вызывает зарастание водопроводных сетей и водоразборной арматуры, является причиной брака в текстильной, пищевой, бумажной, химической и других отраслях промышленности. Повышенное содержание железа в питьевой воде вредно для здоровья человека. При продолжительном введении в организм железа избыток его накапливается в печени в коллоидной форме оксида железа, получившей название гемосидерина, который вредно действует на клетки печени, вызывая их разрушение. Поэтому воду с повышенным содержанием железа необходимо обезжелезивать.
Многообразие форм и концентраций железа, встречающихся в природных и сточных водах, вызвало необходимость разработки целого ряда методов, технологических схем и сооружений обезжелезивания воды. Большой вклад в решение проблемы обезжелезивания природных и оборотных вод внесли российские ученые И.Э. Апельцин, В.А. Клячко, Г.И. Николадзе, Л.А. Кульский, А.М. Перлина, К.А. Мамонтов, Г.Ю. Асс.
В поверхностных водах железо обычно встречается в виде органических и минеральных комплексных соединений, либо коллоидных или тонкодисперсных взвесей. Преобладающей формой существования железа в подземных водах является бикарбонат железа (II), который устойчив только при наличии значительных количеств углекислоты и отсутствии растворенного кислорода. Наряду с этим железо встречается в видесульфида, карбоната и сульфата железа (II), комплексных соединений с гуматами и фульвокислотами.
Гидроксид железа может присутствовать в воде в коллоидном состоянии, которое является одной из основных форм существования. Оно в значительной степени повышается благодаря защитному действию гумусовых веществ в результате того, что частицы неустойчивого в воде (гидрофобного) коллоида адсорбируют на своей поверхности частицы другого коллоида, который имеет более сильную связь с молекулами воды, т. е. обладает гидрофильным характером. Железо может быть переведено,из этого комплекса в осадок двумя путями: естественным - при участии бактерий, разрушающих органическое вещество, и искусственным - с помощью сильных окислителей, уничтожающих защитные коллоиды. Вместе с тем выпадению гидроксида железа из коллоидного состояния в осадок способствует наличие противоположно заряженных золей кремниевой кислоты (коагуляции).

Рис. 1. Диаграммы Пурбе для железа (а) и марганца (б).
На рис. 1, а представлена диаграмма Пурбе, отражающая состояние системы железо - вода в координатах окислительно-восстановительный потенциал - значение рН. Вертикальными прямыми показаны значения рН гидратообразования при реально устанавливающемся равновесии в системе. Как следует из диаграммы, при значениях рН<4,5 железо находится в воде в виде ионов Fe3+, Fe2+ и Fe(OH)2+. Повышение значения рН приводит к окислению железа(II) в железо(III), которое выпадает в осадок. В этих же условиях при Е<0,2 В и наличии в воде сульфидов может выделяться черный осадок FeS. В восстановительной среде в присутствии карбонатов и при рН>8,4 возможно выделение карбоната, а при рН> 10,3 - гидроксида железа (II).
При наличии катализаторов - растворенных в обрабатываемой воде ионов меди, марганца и фосфат-ионов, а также при контакте ее с оксидами марганца или с ранее выпавшим гидроксидом железа(III) скорость окисления железа(II) кислородом значительно возрастает (рис. 2.2, а). С повышением значения рН среды время, затрачиваемое на окисление соединений железа (II), значительно сокращается. Окисление железа (И) кислородом воздуха происходит по реакции
4Fe2+ + 02 + 8НСО3- + 2Н2О = 4Fe(ОН)3 + 8С02


Рис. 2. Графики оксидации железа (И) кислородом в присутствии катализаторов (а) и кинетика его оксидации кислородом, хлорамином и хлором (б) при различных рН воды. 1 - без катализатора; 2, 3 - в присутствии меди и диоксида марганца (дозы по 0,02 мг/л); 4 - в присутствии гексаметафосфата (доза 2 мг/л);
По стехиометрии на окисление 1 мг железа (II) расходуется 0,143 мг растворенного в воде кислорода; щелочность воды при этом снижается на 0,036 мг-экв/л. Скорость окисления соединений железа(II) значительно возрастает при хлорирование воды (нормальный окислительно-восстановительный потенциал хлора Е=1,36 В). Соединения железа(II) в присутствии гидрокарбонатов природных вод полностью гидролизуют по реакции:
2Fe2+ + С12 + 6НСО3- = 2Fe(ОН)3 + 2Сl+ 6С02
По стехиометрии на окисление 1 мг железа (II) расходуется 0,64 мг хлора; щелочность воды при этом снижается на 0,018 мг-экв/л. Как видно из рис. 2.2, б, при замене свободного хлора дихлорамином (Е=0,66В при рН 5) время, необходимое для окисления соединений железа (II), значительно возрастает.
При обработке воды перманганатом калия реакция окисления и последующего гидролиза протекает по уравнению
4Fe2+ + МnО4- + 8НСО3- + 2Н20 = 4Fe(ОН)3 + МnО2 + 8С02
По стехиометрии на окисление 1 мг железа (II) расходуется 0,71 мг перманганата калия; щелочность воды при этом уменьшается на 0,036 мг-экв/л.
Для деферризации воды следует использовать несколько методов адекватно формам, количеству железа и буферным свойствам исходной воды. Все многообразие методов, применяемых в технологии обезжелезивания воды, можно свести к двум основным типам, реагентные и безреагентные. Из применяемых в настоящее время безреагентных методов обезжелезивания воды перспективными являются: вакуумно-эжекционная аэрация и фильтрование (рис. 2.3, а); упрощенная аэрация и фильтрование; «сухая фильтрация»; фильтрование на каркасных фильтрах; фильтрование в подземных условиях с предварительной подачей в пласт окисленной воды или воздуха (рис. 2.4); аэрация й двухступенчатое фильтрование; ультрафильтрация.
К реагентным относятся следующие методы: упрощенная аэрация, окисление, фильтрование, напорная флотация с известкованием и последующим фильтрованием; известкование, отстаивание в тонкослойном отстойнике и фильтрование-, фильтрование через модифицированную загрузку; электрокоагуляция, катионирование; озонирование и фильтрование.

Многообразие методов обезжелезивания воды исключает их равноценность в отношении надежности, технологичности, экономической целесообразности, простоты, области применения и т. п. Обезжелезивание поверхностных вод можно осуществить лишь реагентными методами, а для удаления железа из подземных вод наибольшее распространение получили безреагентные методы.
Безреагентные методы обезжелезивания могут быть применены, когда исходная вода характеризуется: рН - не менее 6,7; Щелочностью - не менее 1 мг-экв/л; перманганатная окисляемость - не более 7 мг 02/л. При этом при содержании железa(III) не более 10% от общего и концентрации железа(П) в бикарбонатной или карбонатной форме до 3 мг/л рекомендуется метод фильтрования на каркасных фильтрах без вспомогательных фильтрующих средств, до 5 мг/л предпочтительно применять метод сухой фильтрации от 5 до 10 мг/л следует использовать метод упрощенной аэрации с одноступенным фильтрованием; от 10 до 20 - аэрация и двухступенчатое фильтрование; от 10 до 30 мг/л - рекомендуется вакуумно-эжекционная аэрация с фильтрованием через загрузку большой грязеемкости.

При концентрации углекислого или карбонатного железа(П) более 20 мг/л или при содержании сероводорода 1...5 мг/л, рН 6,4 рекомендуется метод вакуумно-эжекционной аэрации с последующим отстаиванием в тонком слое воды или обработкой в слое взвешенного осадка и фильтрование.
Реагентные методы обезжелезивания воды следует применять при низких значениях рН, высокой окисляемости, нестабильности воды. При этом при содержании сернокислого или карбонатного железа, либо комплексных железоорганических соединений: до 10 мг/л и перманганатной окисляемости до 15 мг O2/л рекомендуется применять фильтрование через модифицированную загрузку, до 15 мг/л и перманганатной окисляемости до 15 мг 02/л предпочтителен метод, предусматривающий упрощенную аэрацию, обработку сильным окислителем и фильтрование через зернистую загрузку большой грязеемкости; свыше № мг/л и перманганатной окисляемости более 15 мг/л следует применять напорную флотацию с предварительным известкованием и последующим фильтрованием или метод, предусматривающий аэрацию, известкование, отстаивание в тонком слое и фильтрование; свыше 10 мг/л, перманганатной окисляемости более 15 мг 02/л при производительности установок до 200 м3/сут можно рекомендовать электрокоагуляцию с барботированием, отстаиванием в тонком слое и фильтрование.

Рис. 2.3. Технологические схемы установок обезжелезивания воды.
а - вакуумно-эжекциоииой аэрации и фильтрования; б - упрощенной аэрации с одноступенчатым фильтрованием; в - упрощенной аэрации с двухступенчатым фильтрованием; г - сухой фильтрации; д - известкования; е - фильтрованием через намывной слой; 1 я 8- подача исходной и отвод обезжелезенной воды; 2 - вакуумно-эжекционный аппарат; 3 - каркасно-засыпные фильтры; 4 - резервуар промывной воды; 5 - повысительный насос; 6 и 11 - установка для фторирования и обеззараживания воды; 7 - водонапорный бак; 9 - воздуходувка; 10 - скорый осветлительный фильтр; 12 - аэрационное устройство; 13 - осветлительный фильтр II ступени; 14 - сброс воздуха; 15 - скорый фильтр с «сухой загрузкой»; 16 - смеситель; 17 - вихревая камера хлопьеобразования; 18 - тонкослойный отстойник; 19 - намывной фильтр
![]()
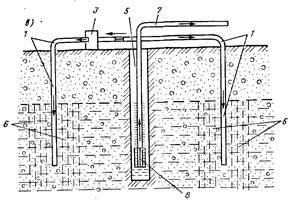

Рис. 17.4. Схемы очистки подземных вод в пласте.
а - система «Гидрооксиринг», б - односкважинная установка; в - многоскважинная. 1 - вспомогательная скважина, 2 - трубопровод, 3 - устройство для аэрации воды, 4 - кольцевой инфильтрационный бассейн, 5 - эксплуатационная скважина, 6 -зона аэрации, 7 - отвод воды потребителю, 8 - насос, 9 - трубопровод подачи воды в сборную емкость, 10 - эжектор, 11 - трубопровод подачи воды из сборной емкости в скважину, 12 - сборная емкость
Обезжелезивание воды катионированием целесообразно лишь в тех случаях, когда одновременно с обезжелезиванием требуется умягчение воды, при этом ионным обменом могут быть лишь извлечены ионы железа (II).
Метод упрощенной аэрации (см. рис. 17.3, б) применим как в гравитационном, так и в напорном варианте в зависимости от производительности установки. Помимо вышеуказанных, показателями применимости этого метода являются условия, когда Е воды после аэрации будет не менее +100 мВ и индекс стабильности воды (J) не менее +0,05. Метод упрощенной аэрации основан на способности воды, содержащей двухвалентное железо и растворенный кислород, при фильтровании через зернистый слой выделять железо на поверхности зерен, образуя каталитическую пленку из ионов и оксидов двух- и трехвалентного железа. Эта пленка активно интенсифицирует процесс окисления и выделения железа из воды. Обезжелезивание воды в загрузке, покрытой пленкой, является гетерогенным автокаталитическим процессом, в результате чего обеспечивается непрерывное обновление пленки как катализатора непосредственно при работе фильтра.
При этом методе не требуется окисление двухвалентного железа в трехвалентное и перевод его в гидроксид в связи с чем отпадает необходимость в устройстве дорогостоящих аэрационных сооружений. Упрощенная аэрация осуществляется с помощью несложных приспособлений путем излива воды с небольшой высоты в карман или центральный канал фильтра, либо путем вдувания воздуха в обрабатываемую воду. Отсутствие специальных аэрационных устройств и контактных емкостей упрощает эксплуатацию и снижает стоимость очистки.
Для расчета фильтрующей загрузки при обезжелезивании додземных бикарбонатных и карбонатных вод по методу упрощенной аэрации рекомендуется эмпирическая формула Г.И. Николадзе
![]() (17.1)
(17.1)
где L - толщина слоя фильтрующей загрузки: м; и -скорость фильтрования, м/ч; d3 - эквивалентный диаметр фильтрующей загрузки, мм; Л=СИ/СФ (здесь СИ и Сф - содержание железа (II) соответственно в исходной воде и в фильтрате, мг/л); К- константа реакции окисления железа (II), определяемая эмпирическим путем; а и n - соответственно коэффициент формы зерен и пористость фильтрующей загрузки; t1 - температура исходной воды, °С; -содержание в воде растворенного кислорода, мг/л.
Сущность метода «сухой фильтрации» (см. рис. 17.3, г) заключается в фильтровании воздушно-водяной эмульсии через «сухую» (незатопленную) зернистую фильтрующую загрузку путем образования в ней вакуума или нагнетания больших количеств воздуха с последующим отсосом из поддонного пространства. В обоих случаях в поровых каналах фильтрующей загрузки образуется турбулентный режим движения смеси, характеризующийся завихрениями и противотоками, что способствует молекулярному контакту воды с поверхностью зерен контактной массы. При этом на зернах фильтрующей загрузки формируется адсорбционно-каталитическая пленка из соединений железа (и марганца, если он присутствует в воде), повышая эффективность процессов деманганации и обезжелезивания.
Особенностью процесса является образование дегидратированной пленки на зернах загрузки (песок, керамзит, антрацит, винипласт, полистирол, полиметилметакрилат и др.), состоящей, как показали рентгенографические определения, из магнетита, сидерита, гетита и гематита. Указанные соединения имеют плотную структуру, а объем их и 4...5 раз меньше, чем гидроксида железа. Поэтому темп прироста потерь напора в фильтрующей загрузке при напорном фильтровании по методу «сухой фильтрации» чрезвычайно мал, а продолжительность фильтроцикла - велика (от нескольких месяцев до года и более). Характерными особенностями процесса являются: минимальный период «зарядки» фильтрующей загрузки (т. е. образование на поверхности зерен активной адсорбционной пленки), составляющий от 0,3 до 2 ч, повышение рН и некоторое снижение жесткости фильтрата, высокая грязеемкость загрузки и отсутствие промывных вод (загрузка отмывается от соединений железа 0,5...1 %-ным раствором дитианита или заменяется на новую, можно отмывать 5...10°/о-ным раствором ингибированной соляной кислоты). В фильтрате обычно наблюдается железо(II) и следы Fe (III). Продолжительность, сут. фильтроцикла, фильтра работающего по схеме «сухой фильтрации», по Г. И. Николадзе равна
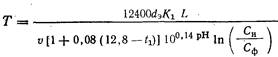
где К1 - воздушно-водяное отношение. Остальные обозначения см. к формуле (17.1).
Метод упрощенной аэрации с двухступенчатым фильтрованием (рис. 17.3, в) предпочтительно применять в напорном варианте. Сущность процесса аналогичная описанной выше. В самом начале процесса обезжелезивания при поступлении на фильтр первых порций воды, когда загрузка еще чистая, адсорбция соединений железа на ее поверхности происходит в мономолекулярном слое, т. е. имеет место физическая адсорбция, обусловленная силами притяжения между молекулами адсорбата и адсорбента (поверхность твердого тела - адсорбента насыщается молекулами адсорбата). После образования мономолекулярного слоя процесс выделения соединений железа на зернах песка не прекращается, а наоборот, усиливается вследствие того, что образовавшийся монослой химически более активен, чем чистая поверхность песка. Электронно-микроскопические исследования пленки показали, что она состоит из шаровых молекул гидроксида железа и других соединений, как железа(III), так и железа(II). Количество связанной воды в пленке достигает 20%. Величина истинной поверхности пленки составляет не менее 200 м2/г.
Адсорбционные свойства пленки из соединений железа на зернах фильтрующей загрузки, высокая ее удельная поверхность и наличие большого количества связанной воды позволяют сделать вывод, что пленка представляет собой очень сильный адсорбент губчатой структуры. Одновременно, пленка является катализатором окисления поступающего в загрузку железа(II). В связи с этим эффект очистки воды зернистым слоем несравненно выше, чем это могло быть в гомогенной среде.
Для катализатора такого типа некоторые вещества, находящиеся в воде (аммиак, сероводород, свободная углекислота, коллоидная кремнекислота), являются «ядами». Молекулы этих веществ имеют по паре свободных электронов, которые могут участвовать в образовании ковалентных связей с поверхностью катализатора, что при значительных концентрациях этих соединений приводит к понижению его активности.
Процесс описывается следующим уравнением:
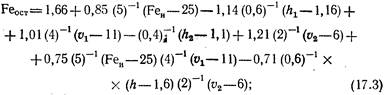
где Feости FeH- соответственно содержание железа в фильтрате фильтра II ступени и в обрабатываемой воде, мг/л; h1 и h2 - соответственно высоты слоев фильтрующей загрузки на фильтрах I и II ступеней; v1 и i>2 - соответственно скорости фильтрования на фильтрах I и II ступеней.
Метод фильтрования на каркасных фильтрах следует применять для обезжелезивания воды на установках производительностью до 1000 м3/сут. Сущность обезжелезивания воды по рассматриваемому методу заключается в том, что железо (II) после окисления переходит в осаждающееся железо(III). Гидроксид железа, формирующийся в нижней части аппарата, намывается на патрон. При этом в начале процесса решающую роль играет различие в зарядах керамического патрона, хлопьев гидроксида железа и ионов железа (II). Нарастающий на патроне слой гидроксида железа служит контактным материалом для новых постоянно намываемых агрегатов, при этом происходят как физические, так и химические процессы. Патрон служит только опорным каскадом для фильтрующего слоя гидроксида железа.
При обезжелезивании природных вод на патронных фильтрах.первой стадии процесса является фильтрование с постепенным закупориванием пор фильтрующей перегородки. Эта стадия заканчивается по достижении определенного соотношения объема твердых частиц, задержанных в порах, к объему самих пор, после чего наступает вторая стадия - фильтрование с образованием первоначального слоя осадка. На этом заканчивается процесс зарядки фильтра и начинается фильтрование с целью обезжелезивания воды.
Формулы (17.4) и (17.5) позволяют определять количество фильтрата Q,м3/ч, получаемого с 1 м2 фильтрующей поверхности и скорость фильтрования v,м/ч:
Q= 100(37,3-4,8υ-3,5) + 0,27 2 - l,67υ; (17.4)
По Г.И. Николадзе продолжительность фильтроцикла можно определить из выражения
где Δр - перепад давления при фильтровании; mт - масса твердой фазы, задерживаемой фильтрующим каркасом при получении единицы объема фильтрата; - содержание железа в обрабатываемой воде.
Сущность метода аэрации с использованием вакуумно-эжекционных аппаратов (рис. 17,5) заключается в окислении кислородом воздуха железа(II) в окисное с образованием коллоида гидроксида железа, его коагулировании при рН=6,8...7 и выделении в осадок в виде бурых хлопьев. При контакте воды, содержащей железо(II), с воздухом кислород растворяется в воде, окислительный потенциал системы повышается, и если при этом создать условия для удаления части растворенной углекислоты, то рН системы возрастет до значения, обеспечивающего при данном окислительном потенциале выпадение в осадок гидроксида железа(III).
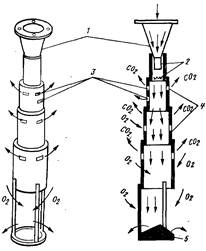
Рис. 17.5. Вакуумно-эжекционное устройство.
а - общий вид; б - разрез по оси аппарата; I - конический сходящийся иасадок; 2 - вакуумная камера; 3 - окна для подсоса воздуха и удаления диоксида углерода;4 - эжекционные камеры; 5 - отражательная пластина (вариант)
При использовании в этой схеме осветлителей со слоем взвешенного осадка процесс по Г.И. Николадзе описывается следующим уравнением:
где Fe0 и FeH- соответственно содержание железа в воде после осветлителя и в обрабатываемой воде, мг/л; b- экспериментальный коэффициент, зависящий от свойств воды, ч-1; Я - Высота взвешенного слоя, м; v- скорость восходящего движения воды во взвешенном слое, м/ч; n - экспонента, учитывающая влияние окисления железа(II) на эффект обезжелезивания воды.
Обезжелезивание воды фильтрованием через модифицированную загрузку основано на увеличении сил адгезии путем воздействия на молекулярную структуру поверхности зерен фильтрующей загрузки. Для увеличения сил адгезии, как показали исследования, необходимо на поверхности зерен фильтрующей загрузки образовать пленку из соединений, имеющих более высокое значение константы Ван-дер-Ваальса. Кроме того, электростатические свойства этих соединений должны обеспечить изменение дзета-потенциала поверхности зерен в нужном направлении. При этом силы адгезии соприкасающихся тем больше, чем" больше молекулярные массы.
Методика модификации загрузки предусматривает ее последовательную обработку 1,5%-ным раствором серно-кислого железа (II), а затем 0,5%-ным раствором перманганата калия. Суммарная продолжительность контакта 30 мин. Спустя 20 мин после начала работы фильтрат отвечает лимитам ГОСТ 2874-82. «Вода питьевая».
Обезжелезивание воды упрощенной аэрацией, хлорированием и фильтрованием заключается в удалении избытка углекислоты и обогащении воды кислородом при аэрации, что способствует повышению рН и первичному окислению железоорганических соединений. Окончательное разрушение комплексных соединений железа (II) и частичное его окисление достигаются путем введения в обрабатываемую воду окислителя (хлора, озона, перманганата калия и т. п.). Соединения закисного и окисного железа извлекаются из воды при фильтровании ее через зернистую загрузку.
Хлор вводится в водяную подушку через специальную распределительную трубчатую систему; при этом требуется обеспечить необходимое время контакта окислителя с обрабатываемой водой. В качестве фильтровального аппарата рекомендуются контактные фильтры КФ-5 с повышенной грязеемкостью. В контактном фильтре КФ-5 фильтрующая загрузка состоит из трех слоев толщиной по 0,6 м: верхний слой - керамзит или полимеры с крупностью зерен 2,3...3,3 мм, средний слой - антрацит или доменный шлак с крупностью зерен 1,25...2,3 мм, нижний слой - кварцевый песок или горелые породы с зернами крупностью 0,8...1,25 мм. Скорость фильтрования 7 м/ч, промывка водяная.
Обезжелезивание методом напорной флотации основано на действии молекулярных сил, способствующих слипанию отдельных частиц гидроксида железа с пузырьками тонкодиспергированного в воде воздуха и всплывании образующихся при этом агрегатов на поверхность воды. Метод флотационного выделения дисперсных и коллоидных примесей природных вод весьма перспективен вследствие резкого сокращения продолжительности процесса (в 3...4 раза) по сравнению с осаждением или обработкой в слое взвешенного осадка.
Процесс напорно-флотационного разделения хлопьев гидроксида железа можно подразделить на следующие стадии: окисление закисного железа в окисное, растворение воздуха в воде и образование пузырьков; образование комплексов «пузырек воздуха - хлопья гидроксида железаподъем этих комплексов на поверхность воды. Каждая стадия оказывает существенное влияние на эффективность и экономичность процесса.
На эффективность процесса всплывания хлопьев при флотационном разделении оказывают влияние концентрация взвешенных веществ (исходная концентрация железа, доза извести), .количество и размер пузырьков, продолжительность флотации, а также гидродинамические условия. Эффект флотации можно определить по формуле
где uп - скорость подъема пузырьков; Т - продолжительность пребывания воды во флотаторе; П - количество пузырьков воздуха в единице объема воды; Н0 - высота слоя воды во флотаторе; а -коэффициент вероятности закрепления пузырьков на хлопке гидроксида железа при подъеме его на 1 см.
При увеличении продолжительности флотации, давления в напорном баке, дозы извести, а также исходного содержания железа, эффект обезжелезивания повышается, а при увеличении количества дисперсионной воды - понижается. Другие факторы, как показывают уравнения регрессии, существенного влияния не оказывают.
где Т - продолжительность пребывания воды во флотаторе, мин; (/ - количество воды, подвергаемое насыщению воздухом, л; Ди -доза извести, мг/"л; р - давление насыщения, МПа; Fe„ - исходная концентрация железа, мг/л; Э - эффект обезжелезивания; Оk - окисляемость.
Снижение окисляемости зависит в основном от количества воды, подвергаемой насыщению воздухом, дозы извести и давления насыщения.
Удаление высококонцентрированных устойчивых форм железа из воды аэрацией, известкованием, отстаиванием в тонком слое и фильтрованием достигается после полного окисления Железа (II) и деструкции комплексных железоорганических соединений при pH≥7,l. Процесс выделения соединений железа в тонкослойном отстойнике носит циклический характер и при этом эффект обезжелезивания воды зависит главным образом от скорости потока в тонкослойных модулях, исходной концентрации железа и дозы щелочного реагента. Для агломерации хлопьев гидроксида железа, седиментирующихся в отстойнике, объем камеры хлопьеобразования вихревого типа, совмещенной с отстойником, должен обеспечивать продолжительность пребывания обрабатываемой воды не менее 15 мин.
Достигаемый в тонкослойных модулях эффект деферизации воды Э, %", зависит от скорости движения потока - v,дозы щелочного реагента - Ди, содержания железа в обрабатываемой воде - FeHи описывается уравнением
Э = 32,23 + 0,33υ - 0,224υ2 + 1,28ДИ-0,007Д2 + 0,37FeH. (17.11)
Скорость движения воды в тонкослойных модулях по Г.И. Николадзе
где l - длина ячейки отстойника, м; υкр - критическая скорость потока в отстойнике, м/ч; А0 - параметр, характеризующий величину концентрации отложений, выпавших в отстойнике, г/л; F- функциональный параметр, зависящий в основном от продолжительности уплотнения осадка и цикла отстаивания, ч; К - содержание нерастворимой взвеси в составе щелочного реагента, мг/л; Fe0 - содержание железа в отстоенной воде.
Fe0=FeH(1 - 0,01Э).(17.13)
обезжелезивание вода флотация
Для удаления сульфата железа (II) применяют известкование, при этом известь реагирует вначале с сульфатом железа (II):
FeS04 + Са (ОН)2 = CaS04 + Fe(ОН)2.
Образующийся гидроксид железа (II) окисляется в Fe(OH)3, при этом, если количество кислорода, содержащегося в воде, недостаточно для окисления, одновременно с известкованием проводят хлорирование или аэрирование воды.
Доза извести (при Ре2+/28>ЩИ), мг/л
![]()
где [СО2] - содержание в воде свободного оксида углерода (IV), мг/л; - содержание в воде железа (II), мг/л; в\ - эквивалентная.масса безводного вещества коагулянта, мг/мг-экв; Щл - щелочность исходной воды, мг-экв/л.
Дозу хлора или хлорной извести определяет по формуле Дхл=0,7[Ре2+], мг/л, а дозу перманганата калия по формуле Дп.м =, мг/л.
В некоторых случаях для быстрого окисления железа(II), даже при низких значениях рН, применяют катализаторы. В качестве таких катализаторов обычно используют дробленый пиролюзит, «черный песок» (песок, покрытый пленкой оксидов марганца, которые образуются в результате разложения 1 %-ного раствора перманганата калия, подщелаченного до рН=8,5...9 водным раствором аммиака) и сульфоуголь, покрытый пленкой оксидов марганца. Для получения последнего сульфоуголь обрабатывают 10%-ным раствором МпС12, а затем через слой образовавшегося Mn-катионита фильтруют 1%-ный раствор КМnО4. Калий вытесняет марганец, который окисляется и осаждается на поверхности угля в виде пленки оксидов марганца. В этих случаях для окисления железа (II) вода должна фильтроваться со скоростью 10 м/ч через слой катализатора толщиной 1 м.
Процесс окисления железа (II) высшими оксидами марганца, которые при этом восстанавливаются до низших ступеней окисления, а затем вновь окисляются растворенным в воде кислородом, описывается уравнениями:
4Fe (HC03)2+3Mn02 + 2Н20 -> 4Fe(ОН)3 + MnO+ Mn203 + 8С02 , ЗМnО + 2KMn04 + Н20 -> 5Mn02 + 2КОН,
ЗМn203 + 2КМn04 + Н20 -> 8Мn02 + 2КОН.
Обезжелезивание воды катионированием допускается применять при необходимости одновременного удаления солей железа и солей, обусловливающих жесткость, и когда в обрабатываемой воде отсутствует кислород.
Обезжелезивание поверхностных вод осуществляют при одновременном осветлении и обесцвечивании. Железо, находящееся в воде в виде коллоидов, тонкодисперсных взвесей и комплексных соединений, удаляется обработкой воды коагулянтами [сульфатом алюминия, хлоридом железа (III) либо смешанным коагулянтом]. Для разрушения комплексных органических соединений железа воду обрабатывают хлором, озоном или перманганатом калия. При использовании железных коагулянтов обеспечивается более полное удаление железа из воды в результате интенсивной адсорбции ионов железа на хлопьях Fe(OH)3. Оптимум адсорбции ионов железа как в случае применения алюминиевых, так и железных коагулянтов лежит в интервале значений рН воды 5,7...7,5. Доза коагулянта устанавливается экспериментально. Технологическая схема обезжелезивания воды методом коагулирования включает реагентное хозяйство, смесители, осветлители и фильтры.
В институте общей и неорганической химии АН Украины разработан метод обезжелезивания воды с применением алюмината натрия и хлорида железа (III). Таким методом удаляется железо, находящееся в воде в виде неорганических и органических (гумусовых) соединений. Одновременно устраняется коллоидная кремниевая кислота, марганец, неорганическая взвесь и органические вещества. Оптимальное соотношение FeCl3 и NaA102 - 1:1. Остаточное содержание в воде железа не превышает установленных норм для питьевой воды. Кроме того, разработан метод удаления железа из воды фильтрованием через взвешенный слой тонкодисперсного мела и гидроксида алюминия. Соли железа переводятся мелом в карбонат железа (II), который гидролизуется в гидроксид железа (III). Гидроксид железа (III) задерживается взвешенным слоем. Весь комплекс происходящих реакций можно выразить уравнением
4СаС03+ 4FeS04 + 02 + 6Н20 = 4Fe(ОН)3 + 4CaS04 + 4С02
Оптимальное соотношение основных компонентов А1(0Н)з/ /СаС0з=0,16. Расчетная скорость восходящего потока через взвешенный слой мела достигает 0,48 мм/с. Концентрация мела во взвешенном слое составляет 0,02...0,03 г/см3. Этим методом удаляется до 95% общего железа, находящегося в воде.
Гидроксиды железа из воды наиболее эффективно извлекаются в осветлителях со слоем взвешенной контактной среды. Благодаря гетерогенно-каталитическому процессу железо(II) в слое взвешенной контактной среды окисляется быстрее. На эффект обезжелезивания влияют рН; температура, исходная концентрация железа, высота слоя осадка и скорость восходящего потока воды. При коагуляции без известкования эту скорость принимают равной 0,8 мм/с, с известкованием - 1,0 мм/с. Высоту слоя взвешенной контактной среды в осветлителе принимают равной 2 м, высоту защитного слоя воды над осадком - 1,5 м. Объем осадкоуплотнителя в осветлителе должен обеспечивать пребывание в нем осадка в течение 6 ч. Количество отсасываемой в осадкоуплотнитель воды составляет 20...30%.
В составе обезжелезивающих установок применяют скорые одно- и двухслойные фильтры. При размере зерен 0,6...1,2 мм толщину фильтрующего слоя принимают равной 1,0...1,5 м. Скорость фильтрования на скорых фильтрах 5 ... 7, а на двухслойных - до 10 м/ч. Для очистки фильтрующих слоев применяют водовоздушную промывку, дополняя ее верхней промывкой.
ЛИТЕРАТУРА
1. Алексеев Л.С., Гладков В.А. Улучшение качества мягких вод. М., Стройиздат, 1994 г.
2. Алферова Л.А., Нечаев А.П. Замкнутые системы водного хозяйства промышленных предприятий, комплексов и районов. М., 1984.
3. Аюкаев Р.И., Мельцер В.3. Производство и применение фильтрующих материалов для очистки воды. Л., 1985.
4. Вейцер Ю.М., Мииц Д.М. Высокомоллекуляриые флокулянты в процессах очистки воды. М., 1984.
5. Егоров А.И. Гидравлика напорных трубчатых систем в водопроводных очистных сооружениях. М., 1984.
6. Журба М.Г. Очистки воды на зернистых фильтрах. Львов, 1980.
Обезжелезивание — удаление железа и марганца из воды — это сложная задача для быта и производства. Нет универсального метода на все случаи, который был бы при этом экономически оправдан на всех объектах. Если бы он был — мы бы все о нем знали. Однако, методов много и каждый из них применим в определенных пределах и, конечно, имеет свои недостатки. Большинство людей пишут мне: «Павел, железо в воде. Фирмы предлагают разные методы от 30 до 150 тысяч рублей. Кому верить? Что делать?»
 Клапан управления обезжелезивателем
Клапан управления обезжелезивателем
Сверху на фильтре устанавливают
Клапан управления представляет собой систему каналов, по которым движется вода, запорный механизм, направляющий воду по нужному на данном этапе цикла каналу и блок управления с электроприводом для автоматического клапана, либо ручку для ручного переключения режимов для ручного клапана управления.
Фильтры бывают трехцикловые для безреагентных обезжелезивателей, либо пятицикловые для реагентной промывки. Реагентная промывка — это не просто взрыхление загрузки, а пропускание через загрузку реагента (например, раствора перманганата калия) для более глубокой очистки загрузки и восстановления ее каталитических свойств.
Переключая режимы с помощью ручки, либо автоматически за счет электронного блока управления мы организуем промывку фильтра.
Во время промывки фильтра вода не поступает к потребителю, а выбрасывается в дренаж (канализацию).
Промывка происходит в несколько этапов, там есть свои важные нюансы. Рекомендую изучить
После завершения очередной промывки фильтр снова готов к работе. Загрузка фильтра при правильной эксплуатации обычно «живет» (работает) от 3-5 лет.
Окисление и фильтрация пиролюзитом (MnO2).
Этот метод прекрасно подходит для удаления небольшого количества двухвалентного железа Fe(OH)3 в простых условиях и для небольшого расхода воды. Высокий pH, отсутствие органики и сероводорода в воде — обязательные условия. Суть метода в том, чтo мы окисляем железо с помощью волшебного компонента загрузки фильтра без аэрации, без дозации, без озона, без реагентов — только обезжелезиватель с загрузкой: сорбент + пиролюзит .
Пиролюзит — это природный минерал. Диоксид марганца. Его применяют для производства батареек . Из него делают марганцовку (KMnO 4) и вообще он довольно широко применяется в химической промышленности. В водоподготовке пиролюзит MnO2 используется, как каталитический материал удаления железа, марганца, органический соединений, сероводорода, потому что пиролюзит является неплохим окислителем.
Пиролюзит в водоподготовке — материал уникальный. Почти все каталитические материалы сделаны с использованием пиролюзита:
BIRM — это легкий сложнопористый алюмосиликат с нанесением пиролюзита в качестве наружнего каталитического слоя. Идея — супер, но живет не долго и боится органики.
Greensand Plus — кварцевый песок с нанесением пиролюзита на поверхность крупиц. Работает только при постоянной дозации гипохлорита или промывке марганцовкой.
МЖФ, МСК, Pyrolox, Сорбент МС и множество других материалов — все это сделано с применением пиролюзита.
 Обезжелезиватель на пиролюзите. Умягчитель — опция. Его может и не быть.
Обезжелезиватель на пиролюзите. Умягчитель — опция. Его может и не быть.
При этом пиролюзит — это минерал, содержащий 75-95% MnO2 , он поставляется гранулированным, подходящей фракции. Дешевый, но очень тяжелый. Для его промывки требуется быстрый поток воды. Чем больше диаметр колонны, тем больше требуется давление в системе для создания потока нужной скорости для ожижения загрузки.
Однако, пиролюзит можно использовать, как реагентную добавку к сорбенту МС для удаления без окисления небольшого количества железа и марганца. У Вас одна колонна — обезжелезиватель с загрузкой — сорбент + пиролюзит. Без реагентов. Без аэрации или другого вида окислителя. Эта система в некоторой степени уникальна. Никакой другой материал, кроме пиролюзита не способен годами окислять металлы растворенные в воде без активного окисления или реагентной регенерации. Потому что мы используем не продукты, содержащие пиролюзит (BIRM, Greensand, МЖФ и т.п.), а собственно, сам пиролюзит. В процессе эксплуатации он практически не расходуется, может немного «пылить» — давать серую воду — истираясь вымываться в водопровод в режиме фильтрации, но это касается не только пиролюзита, а всех вообще загрузок. Можно поставить угольный фильтр с картриджем на выходе, чтобы избежать попадания частиц пиролюзита в водопровод и я рекомендую устанавливать систему обратного осмоса для получения питьевой воды на кухне, т.к. при некоторых дополнительных условиях пиролюзит может отдавать марганец потребителю, возможно незначительное превышение ПДК.
Условия использования ПИРОЛЮЗИТА в качестве окислителя железа:
- Железо Fe(OH)2 <3мг/л
- Марганец Mn2+ <0,2мг/л
- pH >6,8
- Перманганатная окисляемость <2
- Сероводород < 0,005
Если данные условия соблюдаются — я рекомендую использовать колонну 1354 для получения до 1,5 куб м чистой воды в час. Промывку фильтра следует делать раз в несколько дней. В случае с ручным клапаном допустимо растянуть цикл для промывки раз в неделю.
Стоимость обезжелезивателя на пиролюзите
Ионный обмен (Умягчение)
Для удаления различных примесей из воды, в том числе растворенных металлов и органических соединений уже более 50 лет используют ионообменные смолы — катиониты и аниониты в различных комбинациях, требующие регенерации поваренной солью NaCl в таблетках.
Процесс удаления солей и металлов на ионообменных смолах называется умягчением . Изначально этот метод применялся и сейчас применяется в основном для удаления солей жесткости (соли кальция, магния). Однако, сейчас есть большой выбор ионообменных смол и для удаления железа, а так же органики.
Ионообменные смолы — это очень обширная тема. Мы говорим здесь исключительно о бытовой водоочистке и я буду сообщать только то, что следует знать о смолах в ключе нашей задачи — очистить воду в частом доме, либо на малом производстве от растворенных металлов.
Что же представляет из себя Смола? Это синтетические шарики, изготовленные из полимерных материалов. Они очень мелкие, их много, они похожи на мелкую икру минтая, щуки или на «тобико» — икру летучей рыбы. Мы, монтажники водоочистки, даже ради забавы называем смолу «икрой» на профессиональном сленге.

Суть процесса умягчения принципиально отличается от обезжелезивания . Смолы не окисляют и не переводят растворенные вещества в твердую форму для последующего фильтрования, а замещают («впитывают») растворенные вещества в воде на катионы натрия, который не придает воде такого свойства, как жесткость. Общая солевая насыщенность воды при этом остается неизменной или даже возрастает. Это зависит от типа растворенных веществ, которые забирает смола.
Исходя из вышесказанного возникает важный параметр ионообменных смол — ионообменная емкость смолы. Емкость смолы подобна емкости электрической батарейки. Есть запас натрия, который в процессе ионного обмена постепенно расходуется, тем самым снижается способность смолы забирать из воды растворенные вещества. Когда заканчивается натрий — заканчивается и очистка — вода проходит через толщу смолы не изменяя своих свойств.
Мы заранее рассчитываем работу умягчителя таким образом, чтобы сделать регенрацию (промывку) смолы раствором поваренной соли до наступления ощутимого снижения емкости. Этот период называется в водоочистке фильтроциклом. О расчете количества смолы, соли для регенерации, фильтроцикла читайте в статье об умягчении.
Такие мультикомпонентные загрузки, как Экотар, Экомикс, FeroSoft, АПТ-2, Ionofer c различными индексами А, В, С и т.д. предназначены для удаления ионным путем растворенных солей, металлов, органических соединений, а также широкого спектра других веществ: тяжелые металлы, ионы аммония, железоорганические соединения, фосфор, кальций, кремний и многие другие.
Как я уже сказал — смола регенерируется с помощью таблетированной поваренной соли NaCl, соль продается на всех строительных рынках, в магазинах сантехники, стоит примерно 7$ за 30кг мешок. Расход соли определяется в основном количеством удаляемых веществ.
В среднем около 1 мешка соли в месяц уходит на умягчение воды.
Обратный осмос.
Системы обратного осмоса — это принципиально иной метод очистки воды. Здесь мы имеем дело с фильтрованием воды сквозь мембрану. Грубо говоря это сетка, через которую проходят молекулы воды, но не проходят молекулы солей жесткости и растворенных металлов. При этом задержанные молекулы не образуют осадка на поверхности мембраны, а сразу же сливаются в дренаж (канализацию). В процессе фильтрации в обратном осмосе вода разделяется на два потока — пермеат (очищенная)и концентрат (грязная вода).
В среднем на 1 куб.м. очищенной воды мы получаем полтора куба концентрата, который надо куда-то сливать.
Системы обратного осмоса эффективны при удалении растворенных металлов и солей жесткости. Они не замещают одни вещества другими, как ионообенные смолы, а реально очищают воду от примесей, в этом огромное преимущество обратного осмоса. Но это, пожалуй, самый дорогой процесс очистки воды и по причинам целесообразности его реже всего используют для удаления растворенного железа и марганца.
Однако, при высоких содержаниях растворенного двухвалетного Fe2+ железа и низком pH<7 осмос может быть весьма эффективен для удаления 20 и выше мг, потому что молекулы железа гораздо крупнее пор мембраны — их легко фильтровать.
Рассказать друзьям




